
2.(2001年全国高考题)下列化合物中阴离子半径和阳离子半径之比最大的是 ( )
A.LiI B.NaBr C.KCl D.CsF
(本题主要考查离子半径大小比较,答题时注意运用元素周期表定位分析)
1.(2001年全国高考题)下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
(本题综合考查原子结构、同位素、元素周期表的结构等,
答题时要逐项审视,选出错误的说法)
4.粒子半径大小比较的规律
⑴同一主族各元素,原子半径大小看电子层数;
⑵同一周期各元素,原子半径随原子序数递增而递减,阴离子半径一定大于阳离子半径;
⑶核外电子排布相同的离子,原子序数愈小,离子半径愈大;
⑷阴离子半径大于相应原子半径,阳离子半径小于相应原子半径。
典型题点击
3.原子结构与元素周期表关系的规律
⑴电子层数=周期数(电子层数决定周期数)
⑵最外层电子数=主族数=最高正价数=价电子数
⑶负价绝对值=8-主族数(限ⅣA--ⅦA)
⑷原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物的对应水化物的碱性越强,其离子的氧化性越弱;原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成最高价氧化物的对应水化物的酸性越强,其离子的还原性越弱。
2.元素金属性或非金属性强弱的实验标志
⑴金属性强弱:①单质与水或酸反应置换出H2的难易;②元素最高价氧化物对应水化物的碱性强弱;③单质的还原性强弱或离子的氧化性强弱;④原电池反应中的正负极。
⑵非金属性强弱:①单质与H2化合生成气态氢化物难易;②生成气态氢化物的稳定性;③元素最高价氧化物对应水化物的酸性强弱;④单质的氧化性强弱或简单离子的还原性强弱。
1.元素周期律
元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫元素周期律。元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果,这就是元素周期律的实质。
19. W:C2H2 X:H2O2 Y:Na2O2 Z:Na2S

18.⑴O N
S H ⑵NH4+ +
H2O NH3·H2O + H+
NH3·H2O + H+
⑶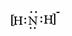 讲析:A、B、C在周期表中有四种可能的位置关系,经讨论计算,A为O,B为N,C为S时符合题意。
讲析:A、B、C在周期表中有四种可能的位置关系,经讨论计算,A为O,B为N,C为S时符合题意。
17. ①三 IA  ②H2CO3 、NaOH、
②H2CO3 、NaOH、
Al(OH)3 、H2SO4、HClO4
③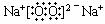 2Na2O2+2CO2
= 2Na2CO3+O2
2Na2O2+2CO2
= 2Na2CO3+O2
④ Al(OH)3 Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
16. X-n X+m X-m X+n 85 55 讲析:若A、B同在第IA族相邻时,两者原子序数相差上一周期元素种类;若A、B同在第VIIA族相邻时,两者原子序数相差下一周期元素种类。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com