
13.(11分)在某次探究性学习中,老师要求同学们在实验室中用氧化铜、稀硫酸和铁来制取纯净的铜,并用所制得的铜进行一系列的探究性实验.
甲、乙两位同学分别设计了如下两个制铜实验方案.
甲:①CuO溶于适量稀硫酸中.
②在①的溶液中加入稍过量的铁,充分反应后,过滤、烘干,即得纯净的铜.
乙:①铁与稀硫酸反应得氢气
②将氢气通入氧化铜中并加热,充分反应后即得纯净的铜.
(1)若两位同学消耗的稀硫酸和铁的量分别相同,请判断他们所制得铜的质量大小关系
________(填选项的标号).
A.相同 B.甲多
C.乙多 D.以上三种情况均有可能
(2)丙同学认为上述两种方案所制得的铜都难以保证铜的纯度,应对上述两种方案加以
完善,甲同学的方案不完善的原因____________________________.完善甲同学的方
案的一种方法是将所得的铜粉放入烧杯中,加入_____________________________,
不断搅拌,然后__________________即得到纯净的铜.
解析:甲的方案中用过量的铁置换出铜,会使得到的铜中含杂质铁,乙的方案由于用
H2还原CuO时H2利用率太低,故用同样的H2SO4所得H2再去还原CuO,所得Cu
将很少.
答案:(1)B (2)甲同学的方案制得的铜中可能混有铁并且没有洗涤 过量稀硫酸 过
滤、洗涤、烘干
12.(11分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在.实验室里从海藻中提取碘的流程如下图所示:

(1)指出提取碘的过程中有关的实验操作名称①________;写出过程②中有关反应的离
子方程式:__________________________.
(2)提取碘的过程中可提供选择的有机试剂为________.
A.酒精、四氯化碳 B.四氯化碳、苯
C.汽油、醋酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒
精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是
____________.
解析:(1)从提取碘的流程图上看出,操作①是将固体(残渣)和液体(含I-的溶液)分离开
的操作,即为过滤.反应②是用Cl2将I-氧化成I2的反应.
(2)利用I2在有机溶剂(如CCl4、苯)中的溶解度远大于在水中的溶解度,用有机溶剂将
碘水中的碘提取出来,其中,酒精、甘油、醋酸均与水互溶,不能萃取碘水中的碘.
(3)操作①中缺少漏斗,操作③中缺少分液漏斗.
答案:(1)过滤 2I-+Cl2===I2+2Cl- (2)B
(3)漏斗、分液漏斗
10.铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2===Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2===2Cu2O+2SO2;2Cu2O+Cu2S===6Cu+SO2↑;
④电解精炼铜.
下列说法正确的是 ( )
A.冶炼过程中的尾气可用来制硫酸
B.上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2
C.在反应2Cu2O+Cu2S===6Cu+SO2↑中,只有Cu2O作氧化剂
D.电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g
解析:1 mol CuFeS2反应,焙烧时需要氧气2 mol;生成的Cu2S转化为Cu2O还需要氧气,B不正确.C项中作氧化剂的除Cu2O外还有Cu2S,C不正确.电解精炼铜时阳极除溶解铜外还溶解比较活泼的金属,当转移1 mol电子时,溶解铜的物质的量小于0.5 mol,D不正确.
答案:A
9.中国新闻网曾报道,位于广东省阳江海域的“南海一号”宋代商船,此前曾打捞出金、银、铜、铁、瓷类文物4000余件,文物界专家认为,“南海一号”价值不亚于兵马俑.下列有关推断不正确的是 ( )
A.金、银、铜、铁等属于过渡金属
B.瓷类器件的主要成分是硅酸盐
C.用硝酸可以检验金制品和铜制品
D.金属在海水中不容易腐蚀
解析:金、银、铜、铁均属过渡金属,A正确;瓷器的主要成分是硅酸盐,B正确;硝酸与Cu能发生反应,而不与金反应,故C正确;金属在海水中容易发生电化学腐蚀,D不正确.
答案:D
8.工业上先后用下列方法制备金属钠:
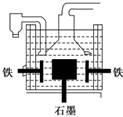 ①用石墨作电极电解熔融氢氧化钠制钠 ②铁与熔融氢氧化钠作用制钠:3Fe+4NaOHFe3O4+2H2↑+4Na↑ ③电解熔融氯化钠
①用石墨作电极电解熔融氢氧化钠制钠 ②铁与熔融氢氧化钠作用制钠:3Fe+4NaOHFe3O4+2H2↑+4Na↑ ③电解熔融氯化钠
下列有关说法正确的是 ( )
A.电解熔融氢氧化钠制钠的反应为:
4NaOH(熔融)4Na+2O2↑+2H2↑
B.在电解熔融氯化钠的电解槽(如右图)中,石墨为阳极,铁为阴极
C.电解熔融氯化钠时,Na+向阳极移动
D.方法①与②制得等量的钠,两反应中转移的电子总数相等
解析:A项中阳极反应4OH--4e-===O2↑+2H2O,阴极反应:4Na++4e-===4Na,因此不可能有H2产生,C项中Na+应向阴极移动,D项中方法①每生成1 mol Na,需转移1 mol电子,方法②需转移2 mol电子.
答案:B
7.从海水中提取单质镁,下列途径正确的是 ( )
A.海水NaOHMg(OH)2电解Mg
B.海水HClMgCl2Mg
C.海水石灰乳Mg(OH)2HClMgCl2电解Mg
D.海水Cl2MgCl2电解Mg
解析:首先向制盐剩下的苦卤里加入熟石灰,得Mg(OH)2,再用盐酸溶解Mg(OH)2得
MgCl2,电解融熔MgCl2得Mg.
答案:C
6.溴、碘主要存在于海水中,有“海洋元素”的美称.海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘.提取碘的途径如下所示:
干海带海带灰水溶液 ―→碘单质
下列有关叙述正确的是 ( )
A.碘元素在海水中也有游离态存在
B.在提取的过程中用的氧化剂可以是H2O2
C.操作A是结晶或重结晶
D.B是提纯操作,常用蒸馏或分馏
解析:碘在海水中只以化合态(I-)存在,没有游离态,A错误.操作A是萃取,操作B是分液,然后才是蒸馏等操作来得到单质碘,A、C、D都是错误的.
答案:B
5.用铝热法还原下列氧化物制得金属各1 mol,消耗铝最少的是 ( )
A.MnO2 B.WO3
C.Cr2O3 D.Co3O4
解析:用铝热法还原金属氧化物时,Al作还原剂,金属氧化物作氧化剂.在反应中金属氧化物被还原为单质,显然,在氧化物中金属化合价越高,变为单质时需获得的电子越多,消耗铝越多;金属化合价越低,得电子数越少,耗铝越少.以上金属氧化物中金属的化合价分别为:Mn(+4)、W(+6)、Cr(+3)、Co(+).Co化合价最低,耗铝最少.
答案:D
4.若将海水淡化作饮用水使用,下列方法在原理上完全不可行的是 ( )
A.加明矾使海水中的盐分沉淀而淡化
B.利用太阳能使海水蒸馏淡化
C.将海水缓慢凝固以获取淡化的饮用水
D.将海水通过离子交换树脂,以除去所含离子
解析:明矾净水的原理是水解生成的Al(OH)3胶体具有吸附悬浮物作用,而对海水中的无机离子起不到任何作用.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com