
10.下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
9.用标准盐酸溶液滴定未知浓度的氢氧化钠溶液,如果测得结果偏低,则产生误差的原因可能是( )
A.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
B.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
C.酸式滴定管未用标准盐酸溶液润洗
D.把氢氧化钠待测液移入锥形瓶中时,有少量碱液溅出
8.常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为( )
A.11:1 B.10:1 C.6:1 D.5:1
7. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是 ( )
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有
c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>
c(OH-)>c(H+)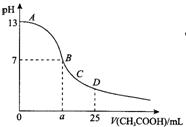
D.在D点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+)
6.在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是A.Ca2+、AlO2-、SO42-、Cl- B.K+、Na+、ClO-、Cl-
C.Na+、Fe2+、NO3-、SO42- D.NH4+、Na+、F-、CO32-
5.根据下列结构示意图,判断下列说法中不正确的是( )
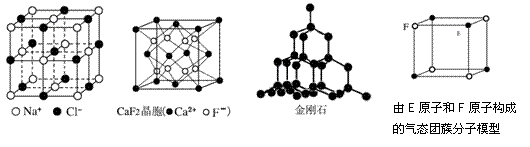
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键数目比为1:2
D.该气态团簇分子的分子式为EF或FE
4.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
① 18g D2O含有的电子数为10NA;② 1mol Na2O2与水完全反应时转移电子数为2NA ;③1molC10H22分子中共价键总数为31NA ;④在标准状况下,22.4LSO3的物质的量为1mol;⑤7.8g过氧化钠中含有的离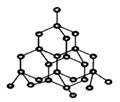 子数为0.3NA;⑥28g 硅晶体(结构如图)中含有2NA个Si-Si键 ;⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA;⑧在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA;⑨标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA;⑩S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
子数为0.3NA;⑥28g 硅晶体(结构如图)中含有2NA个Si-Si键 ;⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA;⑧在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA;⑨标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA;⑩S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A.③⑤⑥⑩ B.①③⑤⑧ C.②④⑥⑦ D.③④⑤⑨
3.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法不正确的是( )
A.若8>m>3,则X必定为主族元素
B.若a<b<m=n=4,则晶体类型相同时,其单质熔点:X > Y
C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
D.若a =b=3,8>m>n>b,则元素非金属性:X>Y
2.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中,正确的是( )
A.X一定是电解质 B.X可能为非电解质
C.X只能的盐类 D.X可能是任何化合物
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子的结构和性质与人体内的血红素及植物休内的叶绿素非常相似。下列说法中不正确的是( )
A.“钴酞菁”分子所形成的分散系不具有丁达尔效应
B.“钴酞菁”分子能透过滤纸
C.此项工作可以用来改变分子的某些物理性质
D.此项工作可广泛应用于光电器件、生物技术等方面
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com