
1、C 2、D 3、A 4、B 5、BC 6、C 7、C 8、D
10.氧化还原滴定实验同中和滴定关系(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液 或反之)。现有0.001mol·L-1酸性KMnO4和未知浓度的无色NaHSO3溶液。反应离子方程式是:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H 2O,填空回答问题:
(1)该滴定实验所需仪器有下列中的 (填序号)
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(10mL) D.锥形瓶
E.铁架台 F.滴定 管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)选何种指示剂 ,说明理由 。
(3)滴定前平视KMnO4液面,刻度为amL,滴定后俯视液面刻度为bmL,则(b-a)mL比实际消耗KMnO4溶液体积 (多、少)。根据(b-a)mL计算,得到的待测液浓度,比实际浓度
(大、小) 。
限时训练10 §3.4 酸碱中和滴定
9.甲、乙两同学用一种标准盐酸去测定同一种未知浓度的NaOH溶液的浓度,但操作不同;甲把一定体积的NaOH溶液放入锥形瓶,把标准盐酸放入滴定管进行滴定;乙把一定体积的标准盐酸放入锥形瓶,把未知液NaOH溶液放入滴定管进行滴定。
(1)甲使用的是 滴定管,乙使用的是 滴定管。
(2)甲同学的滴定管在用蒸馏水洗净后没有用标准盐酸润洗,乙同学的滴定管也没有用NaOH 溶液润洗,其余操作均正确,这样甲测定结果偏 ,乙测定结果偏 .
8.将Cl2通入0.05mol·L-1 H2S溶液中,刚好硫全部析出,此时溶液的PH为 ( )
A.0.1 B.3 C.2 D.1
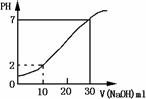
7.如图为10mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示, X和Y的物质的量浓度是( )
|
|
A |
B |
C |
D |
|
X的物质的量浓度(mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y的物质的量浓度(mol/L) |
0.04 |
0.12 |
0.01 |
0.03 |
6.用标准的盐酸滴定未知浓度的NaOH溶液时,下列各操作中,无误差的是( )
A.用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定
B.用蒸馏水洗涤锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C.用碱式滴定管量取10.00mLNaOH溶液放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水 和2滴甲基橙试液后进行滴定
 D.若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入 锥形瓶内,再加入1mL甲基橙指示剂后进行滴定
D.若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入 锥形瓶内,再加入1mL甲基橙指示剂后进行滴定
5.实验标定盐酸浓度时,常称量一定量的无水Na2CO3用盐酸来滴定,甲基橙作指示剂。若使用的Na2CO3中有少量的NaHCO3(其它操作无误),则标定结果( )
A.偏低 B.偏高 C.无影响 D.也可能偏高,也可能偏低
4.常温下,等物质的量浓度、等体积的盐酸分别用PH=9和PH=10的氨水完全中和时,消耗的 氨水的体积分别为V1和V2,则V1、V2的关系中正确的是( )
A.V1=10V2 B.V1>10V2 C.V1<10V2 D.V2>10V1
3.某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.0mL,取出部分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为 ( )
A.大于10.0mL B.小于10.0mL C.等于10.0mL D.等于11.0mL
2.有A、B、C三份等体积等物质的量浓度的烧碱溶液.若将A蒸发掉一部分水,在B中通入少量 CO2气体,C保持原状,然后用同物质的量浓度的盐酸进行滴定,消耗盐酸体积分别为VA 、VB、VC,则三者体积之间的关系是( )
A.VA=VC>VB B.VC>VB>VA C.VB>VC>VA D.VA=VB=VC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com