
3. 38.4mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4ml(标准状况),反应消耗的HNO3的物质的量可能是
A.1.0×10-3mol B.1.6×10-3mol
C.2.2×10-3mol D.2.4×10-3mol
(此题考查质量守恒原理、电子守恒原理的运用能力。)
2.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原的硝酸的物质的量之比为2∶1时,还原产物是
A.NO2 B.NO
C.N2O D.N2
(此题考查铜和硝酸反应的性质知识,电子守恒原理。)
1.用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应,(2)铜跟稀硝酸反应,
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述正确的是
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗的铜的物质的量是途径(3)>途径(1)>途径(3)
D.所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
(此题考查实验的判断能力及计算能力。)
3.硝酸的强氧化性的特殊表现
(1)在利用HNO3的酸性时,必须考虑到其强氧化性,如: 3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
3Na2SO3 + 2HNO3 = 3Na2SO4 + 2NO + H2O
(2)无论浓、稀HNO3均有强氧化性。硝酸越浓,其氧化性就越强。
(3)浓HNO3的氧化性强于稀HNO3。氧化性的强弱是指得电子能力的大小,即指反应的难易程度,而不能用氧化剂得电子的数目多少来衡量。
(4)在与金属的反应中,HNO3不但是强氧化剂,还表现出强酸性,金属与硝酸反应不产生氢气,常用电子守恒原理,质量守恒原理解金属与硝酸的反应问题。
(5)铁在与HNO3反应时,由于有反应:Fe + 2Fe3+ = 3Fe2+,当HNO3过量时,产物为Fe(NO3)3;当Fe过量时产物为Fe(NO3)2;当Fe与HNO3恰好反应时,有可能生成Fe(NO3)2、Fe(NO3)2混合物。
(6)铜与HNO3反应过程中,若铜过量,起始铜与浓HNO3反应生成NO2,反应进行到一定程度时,硝酸渐稀,产物变成NO,最终NO、NO2的混合气体,可通过电子守恒求解,金属与HNO3的反应现象类似铜。
(7)NO3-、H+与S2-、SO32-、I-、Br-、Fe2+离子因氧化-还原反应不能共存。
典型题点击
2.硝酸的化学性质:
(1)强酸性:具有酸的通性。
(2)不稳定性:4HNO3 4NO2 + 2H2O
+ O2
4NO2 + 2H2O
+ O2
硝酸越浓越易分解,因此浓HNO3应存放在棕色试剂瓶中。
(3)强氧化性: HNO3中的+5价N元素具有很强的得电子能力。
HNO3(浓) NO2 HNO3(稀)
NO2 HNO3(稀) NO
NO
如:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
常温下, 浓HNO3使Fe、Al钝化
C + 4HNO3(浓) = CO2 + 4NO2 + 2H2O
王水(浓HNO3与浓盐酸的体积比为1∶3)能溶解Au、Pt。
1.硝酸的物理性质:
纯硝酸为无色有刺激性气味的液体,沸点较低(83℃),易挥发,在空气中遇水蒸气形成硝酸的小液滴而呈白雾状。98%以上的浓硝酸称为“发烟硝酸”,69%的硝酸溶液称为浓HNO3。浓HNO3由于HNO3分解产生的NO2溶于硝酸中而一般呈黄色。
15.{江苏省赣榆高级中学09高三年级十二月 }(12分)下图是某实验室测定黄铁矿中硫元素的质量分数的装置:

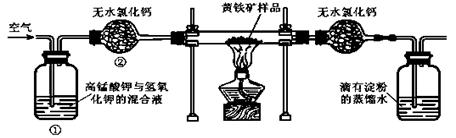
实验时有如下操作:A.将磁管中样品加热到800℃~850℃。 B.称取研细的黄铁矿样品。C.连接好全部仪器,并检查其气密性。 D.将样品小心放入硬质磁管中部。E.以均恒的速度不断鼓入空气。F.用标准碘溶液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤的次序是(以A、B┅的序号表示) 。
(2)装置①的作用是 ;装置②的作用是 。
(3)碘跟SO2水溶液反应的离子方程式为 。
(4)根据 现象判断滴定已达到终点。
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点 (填是或否),请说出你的主要理由 。
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收。若称得矿样的质量为0.0900g,滴定管中碘溶液的初读数为1.10mL,末读数为25.60mL,标准碘溶液的浓度为0.0500 mol·L-1,
 则该黄铁矿样品中硫元素的质量分数为 。
则该黄铁矿样品中硫元素的质量分数为 。
 w.w.w.k.s.5.u.
w.w.w.k.s.5.u. c.o.m
c.o.m
14.{江苏省赣榆高级中学09高三年级十二月 }(B)[实验化学]
甲基橙和酚酞在水中和有机溶剂中的溶解度不同,当溶剂沿滤纸流经混合物点样时,甲基橙和酚酞会以不同的速率在滤纸上移动,从而达到分离的目的。某校化学兴趣小组拟通过该原理将甲基橙和酚酞从混合溶液A中分离开来:
 步骤Ⅰ 把0.1 g甲基橙和0.1
g酚酞溶解在10mL60%的乙醇溶液里,配制混合溶液A;另将10mL乙醇和4mL浓氨水充分混合,配成混合溶液B;
步骤Ⅰ 把0.1 g甲基橙和0.1
g酚酞溶解在10mL60%的乙醇溶液里,配制混合溶液A;另将10mL乙醇和4mL浓氨水充分混合,配成混合溶液B;
步骤Ⅱ 在一张圆形滤纸中心扎一小孔,将细纸芯插入滤纸中央(如图)。在距滤纸中心约1cm的圆周上,选择三个点,分别用毛细管将A溶液在该三点处点样;
步骤Ⅲ 将滤纸覆盖在盛有B溶液的培养皿上,使滤纸芯与溶液接触,放置一段时间,点样逐渐向外扩散,形成黄环;
步骤Ⅳ 待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,等滤纸稍干后,喷上饱和Na2CO3溶液,通过现象判断分离的效果。
试回答下列问题:
⑴本实验采用的分离方法叫_________,若分离淀粉胶体与氯化钠的混合液则可选用______法;
⑵步骤Ⅱ中若在滤纸上事先作点样位置标记,宜选用_____________笔(填“钢”或“铅”);
⑶步骤Ⅳ中喷洒Na2CO3溶液后,能观察到的现象是__________________________,这说明实验中________在滤纸上移动速率更快(填“甲基橙”或“酚酞”);
⑷他们可以通过_____________________________来判断分离的效果。
答案..(B)⑴(纸上)层析法(或色层法或色谱法) 渗析 ⑵铅 ⑶内部为黄环,外部为红环 酚酞 ⑷色斑间的距离大小
13.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
[问题1]工业生产碘酸钾的流程如下:

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式:_________________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是____________。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
[问题2]已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
I2+2S2O32―=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
答案.
[问题1](1)6I2 + 11KClO3 + 3H2O = 6KH(IO3)2 + 5KCl + 3Cl2↑;(2)蒸发结晶;
[问题2](1)分液漏斗(多写烧杯、玻璃棒等合理答案不扣分);(2)1270/3w(423.33/w)。
(3)①4I-+4H++O2=2I2+2H2O;②学生乙的实验结果会偏大。
12.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法海水淡化最理想的能源是 ;
(2)从海水中可得到多种化工原料和产品。下列是利用海水资源的流程图。
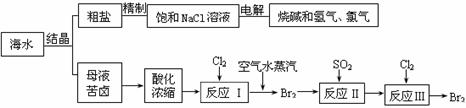
① 反应II的离子方程式为 ;
从反应III后的溶液中得到纯净的单质溴的实验操作方法是 。
② 在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ;
③ 电解25%的饱和食盐水200kg,当NaCl浓度下降到20%时,计算收集到氯气的物质的量。(溶于溶液的氯气忽略不计,计算结果保留一位小数)
答案.(⑴⑵两题每空2分) ⑴太阳能等;
⑵ ① SO2+Br2+2H2O=4H++2Br-+SO42-; 蒸馏(多写萃取不扣分);
② 苦卤样品的体积、Mg(OH)2沉淀的质量;
③ 97.7 mol。 (此小题4分,根据计算过程,酌情给分。)
说明:本试卷中其他合理答案同样给分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com