
27.( 15 分) ( l )四(或4 ) VIII
( 2 ) l :2
( 3 )③
( 4 ) 3Fe2+ + NO3- + 4H+ + = 3Fe3+ + NO↑+2H2O
( 5 ) Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
5(2007全国卷北京考题 )27.(17分)
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是
。
1] (1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O (2)酸性 氧化性 (3)0.6mol (4)使用了较浓的硝酸,产物中有部分二氧化氮生成
4(2007全国卷四川考题 )27.( 15 分)
下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
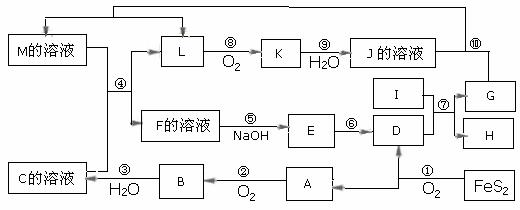
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
( 5 )将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
1、(2007全国卷广东考题 )12.为了避免青铜器生成铜绿,以下方法正确的是
A 将青铜器放在银质托盘上 B 将青铜器保存在干燥的环境中
C 将青铜器保存在潮湿的空气中
D 在青铜器的表面覆盖一层防渗的高分子膜
2(2007全国卷宁夏考题)12. a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
3(2007全国卷上海考题 )24氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
23.已知硬度的表示方法为:将水中Ca2+和Mg2+都看作Ca2+,并将其质 量折算成CaO的质量.通常把1L水中含有10mg CaO称为1度.18℃时,MgCO3的溶解度为0.0 11g,求该温度下,MgCO3饱和溶液的硬度相当于多少度?
知识点:有关硬度的计算.
能力点:理解信息和计算能力.
22.含有0.002mol NaCl的中性溶液100ml使之通过磺化煤酸型阳离子交换剂,令Na+完全转 化为H+,然后再用100ml,蒸馏水洗涤交换剂,所得混合液假设为200ml,求混合液的PH值 (PH=-lg[H+])
知识点:离子交换法
能力点:分解发散的能力
21.怎样软化含Mg(HCO3)2的硬水,写出有关反应式
知识点:硬水的软化方法.
能力点:综合能力
20.“纯净水”、“太空水”、“蒸馏水”等商品作为日常饮料水,因缺少某些成分而不利 于少年儿童身体健康,你认为在制备上述商品饮料水时,至少还需要添加微量的化学物质( )
A.钙和镁的碳酸氢盐 B.小苏打
C.含碘酸盐的食盐 D.漂白粉等消毒剂
知识点:钙、镁等元素在生理上的作用。
能力点:理论联系实际的能力。
19.由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的氢气在 标准状况下为11.2L,则混合物中一定含有的金属是( )
(A)锌 (B)铁 (C)铝 (D)镁
知识点:平均“摩尔电子质量”
能力点:学会化繁为简,找捷径.
18.A、B、C、D、E分别是Cu、Ag、Fe
Al、Mg五种金属中的一种,已知:①A、C均能与稀H2SO4反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体;④C、E在冷浓硝酸中发生钝化.由此可判 断A、B、C、D、E依次为( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
知识点:常见12种金属的性质
能力点:识忆和综合能力
17.甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2(同温、同压下),则加入的铝粉的质量为( )
A.3.6g B.2.7g C.5.4g D.1.8g
知识点:铝分别与盐酸和氢氧化钠作用的性质。
能力点:培养学生综合计算能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com