
A.O2光合作用的产物,缺O2会影响叶绿素的合成
B.O是组成有机物的基本元素之一,光合作用制造的有机物中的氧来自水
C.P是组成ATP的必需元素,光合作用的光反应和暗反应过程中都有ATP合成
D.C是组成糖类的基本元素,在光合作用中C元素从CO2先后经C3和C5形成(CH2O)
2、生物多样性是共同进化的结果。下列事实不属于共同进化的是
A.随着工业的发展,导致大量温室气体排放,全球气温升高
B.随着光合生物的出现,大气中有了氧气,为好氧生物的出现创造了条件
C.生活在草原上的斑马和猎豹都能迅速奔跑,是长期相互选择的结果
D.4亿前年形成了原始的陆生植物,随后出现了适应陆地生活的动物
(六)从海洋中提取溴和碘:
1、海水中提溴
2、海带提取碘
[教学反思]
(五)、重要的卤素化合物及其用途:
例5:为消除碘缺乏病,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO-3可和I-发生反应:IO-3+5I-+6H+====3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO-3。可供选用的物质有:①自来水②蓝色石蕊试纸③碘化钾淀粉试纸④淀粉⑤食糖⑥食醋⑦白酒。进行上述实验时必须使用的物质是
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
(四)、卤素离子的检验
1、Cl-: 2、Br-: 3、I-
(三)、卤素互化物、拟卤素
1、卤素互化物(如ICl、BrCl、ClF5)
ICl+H2O-- BrCl+H2O--
2、拟卤素
有些物质如(CN)2、(SCN)2、(OCN)2等,它们的性质及它们形成的阴离子性质均与卤素单质或阴离子相似,称为拟卤素,它们在在法上也与卤素相似。如:
|
 (2)MnO2+4HCN(浓)====Mn(CN)2+2H2O+
(2)MnO2+4HCN(浓)====Mn(CN)2+2H2O+
它们的氢化物皆为弱酸,银盐均不溶于水。
例4:回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl KBr+BrCl===KCl+Br2①写出KI与IBr反应的化学方程式 。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式 。
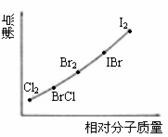
⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是
⑶试推测ICl的沸点所处的最小范围 。
(二)、卤化氢(HX)比较:
1、稳定性
2、沸点
3、还原性:
4、水溶液的酸性:
(一)、卤族元素及其单质性质的通性及递变性
1、 元素周期表中的位置:
2、 原子结构:
3、 单质的相似性、递变性及特殊性:
(1)相似性
(2)递变性
思考与交流:
1、请解释单质熔沸点变化规律?为什么单质在有机溶剂中溶解度较大?
2、实验室应如何保存液溴?能否采用直接加热升华的方法提取碘水中的碘单质?
3、卤素有哪些特殊性?
例1:随着核电荷数的增加,碱金属元素和卤族元素在下列各项中的变化趋势不一致的是
A.原子半径 B.核外电子层数
C.单质在常压下的熔、沸点 D.单质与水反应的剧烈程度
例2:在淀粉碘化钾溶液中,滴加少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,则反应的离子方程式是
。在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失,这是因为
,离子方程式是
,以上实验条件下,ClO-、I2、SO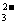 的氧化性由强到弱的顺序是
。
的氧化性由强到弱的顺序是
。
例3、试预测砹及其化合物不可能具有的性质是
A、HAt很不稳定 B、砹是浅黄绿色固体
C、AgAt悬浊液中加入KI溶液后,能逐渐生成黄色不溶物
D、砹易溶于CCl4等有机溶剂 E、沸点:HAt高于HI
F、离子半径:NaAt的熔点高于NaCl G、还原性:HX中HAt最强
H、由KAt的水溶液制备砹的化学方程式为:2KAt+Cl2==2KCl+At2
2、(09天津卷 3)下列实验设计和结论相符的是
3)下列实验设计和结论相符的是
 A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
 D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
感悟高考:
1、(09全国卷Ⅱ
 13)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
13)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是

 A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-

 B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-

 C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-

 D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
2、了解溴和碘及其化合物的主要性质和重要应用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com