
2.例题解析
例1.反应A+3B=2C+2D在四种不同情况下的反应速率分别为:① v(A)= 0.15mol/(L·S)②v(B)= 0.6mol/(L·S) ③v(C)= 0.4mol/(L·S)④v(D)= 0.45mol/(L·S)。其中,反应进行得最快的是( )
A ① B ② C ③ D ④
解析:本反应在四种不同情况下的反应速率分别用四种物质表示,由于该反应的计量系数之比不等于1,因此不能根据题干中的数据进行相对大小的比较,必须将其折算成同一物质表示的反应速率,才能比较其相对大小。若以物质A为标准,将其他物质表示的反应速率换算为用A物质表示的速率,则有:v(A):v(B)=1:3,则②表示的v(A)= 0.2 mol/(L·S)
v(A):v(C)=1:2,则③表示的v(A)= 0.2 mol/(L·S)
v(A):v(D)=1:2,则④表示的v(A)= 0.225 mol/(L·S)
答案:D
 例2.反应C(s) + H2O(g)
CO(g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
例2.反应C(s) + H2O(g)
CO(g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量 B 将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大 D保持压强不变,充入N2使体系体积增大
解析:C为固体反应物,增加其用量对反应速率几乎无影响;容器的体积缩小一半相当于压强增大一倍,浓度增大,正、逆反应速率均增大;体积不变,充入N2使体系压强增大,但反应混合物浓度未改变,反应速率基本不变;充入N2使容器容积增大,总压强不变,但反应混合物浓度同等程度减小,正、逆反应速率均变慢。
答案:A、C
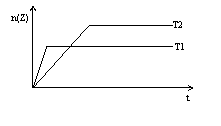
 例3.反应2X(g)+Y(g) 2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
例3.反应2X(g)+Y(g) 2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
 A. T1<T2
, 正反应为放热反应
A. T1<T2
, 正反应为放热反应
B. T1>T2 ,正反应为吸热反应
C. T1>T2 ,逆反应为吸热反应
D. T1<T2 ,逆反应为放热反应
解析:对化学平衡的函数图象分析一般要抓住以下几个方面:
(1)看图象:一看面(即纵坐标与横坐标的意义),二看线(即线的走向和变化趋势),三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等),五看量的变化(如浓度变化、温度变化等)。
(2)在化学平衡图象中,先出现拐点的反应则先达到平衡,可表示温度高(如上图)或压强大。
由图可知,T1时先达到平衡,而无论正反应是放热还是吸热,升高温度都会增大反应速率,因此T1>T2,产物Z的物质的量在高温T1时比低温T2时小,说明降低温度平衡向正反应方向移动,即正反应为放热反应。
答案:C
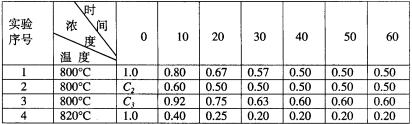
 例4.某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
例4.某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
 根据上述数据,完成下列填空:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为______________mol/(L·min)。
(2)在实验2,A的初始浓度C2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1,且C3 1.0mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是_____反应(选填吸热、放热)。理由是___________________。
解析:本题应从化学反应速率、化学平衡、化学平衡移动原理等方面考虑。
(1)根据化学反应速率的概念可求实验1反应在10 ~ 20 min时间内的反应速率。
(2)分析实验1和实验2可知,两实验达平衡后,A的平衡浓度相同,则A的起始浓度必然相等。从题干可以看出,实验1和实验2达到平衡的时间不同,说明实验2中隐含条件,既能加快反应速率,又不影响化学平衡。
 (3)由实验1数据分析: 2A B + D
(3)由实验1数据分析: 2A B + D
起始浓度(mol·L-1) 1.0 0 0
转化浓度(mol·L-1) 0.5 0.25 0.25
平衡浓度(mol·L-1) 0.5 0.25 0.25
K= 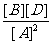 =
= 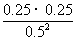 = 0.25
= 0.25
 由实验3数据:
2A B + D
由实验3数据:
2A B + D
起始浓度(mol·L-1) C3 0 0
转化浓度(mol·L-1)C3-0.6 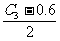
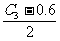
平衡浓度(mol·L-1) 0.6 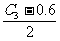
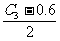
温度不变,平衡常数也不变:
K= 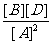 =[
=[ ×
×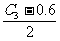 ]/0.62 = 0.25 C3 = 1.2 mol/L
]/0.62 = 0.25 C3 = 1.2 mol/L
(4)比较实验1和4,起始浓度相同,温度不同,实验4中的A的平衡浓度小于实验1,说明温度升高, 平衡正向移动。
答案:(1)0.013 (2)1.0 催化剂 (3)>,>(4)吸热;温度升高时,平衡向右移动
基础训练
1.方法导引
(1)有关化学反应速率的计算和外界条件对可逆反应速率的影响规律是本节的重点。
(2)化学反应速率是用来表示化学反应进行的快慢程度的,同一反应用不同的物质所表示的化学反应速率可能不同。同一反应中各物质的反应速率之比等于其化学方程式中各物质的计量数比。运用此规律,可由一种物质的反应速率求其它物质的反应速率,也可根据速率之比确定方程式中各物质的计量数。
(3)浓度对可逆反应速率的影响:可逆反应同时包含两个反应,因而必须分清某物质是哪一反应的反应 物,如2SO2+O2 2SO3 ,SO2是正反应的反应物,增大SO2的浓度的瞬间V正增大,V逆不变;而增大SO3浓度的瞬间V正不变,V逆增大。溶液和气体可改变浓度;纯液体和固体的浓度为常数;固体反应物的表面积越大,反应速率越大;反应速率与产物的浓度无直接关系。
物,如2SO2+O2 2SO3 ,SO2是正反应的反应物,增大SO2的浓度的瞬间V正增大,V逆不变;而增大SO3浓度的瞬间V正不变,V逆增大。溶液和气体可改变浓度;纯液体和固体的浓度为常数;固体反应物的表面积越大,反应速率越大;反应速率与产物的浓度无直接关系。
(4)无特别指明时,增大压强均指压缩体积;压强对反应速率的影响,实际上是浓度对反应速率的影响,因此反应物是固体或液体时,改变压强对反应速率无影响;用其它方式(压缩体积或扩大体积之外)改变压强,需具体分析反应物浓度是否改变。

 (5)反应速率与化学平衡移动的关系
(5)反应速率与化学平衡移动的关系

应用上述分析问题时应注意
①不要把V正增大与平衡向正反应方向移动等同起来,只有V正>V逆时,才使平衡向正反应方向
②不要把平衡向正反应方向移动与原料转化率的提高等同起来,只有当反应物总量不变时,平衡向正反应方向移动,反应物的转化率提高;当增大一种反应物浓度,使平衡向正反应方向移动时,会使另一种反应物的转化率提高。
4. 影响化学平衡的因素aA(g)+ bB(g) c C(g) + d D(g)
影响化学平衡的因素aA(g)+ bB(g) c C(g) + d D(g)
|
改变条件 |
V正变化 |
V逆变化 |
说明 |
V正、V逆关系 |
平衡移动情况 |
|||

|
升温 |
|
|
ΔH>0 ΔH<0 |
|
|
||
|
降温 |
|
|
ΔH>0 ΔH<0 |
|
|
|||
|
浓度 |
增大反应物浓度 |
|
|
|
|
|
||
|
减小生成物浓度 |
|
|
|
|
||||
|
增大生成物浓度 |
|
|
|
|
||||
|
减小反应物浓度 |
|
|
|
|
||||

|
增大压强 |
|
|
a+b>c+d a+b<c+d |
|
|
||
|
减小压强 |
|
|
a+b>c+d a+b<c+d |
|
|
|||
|
催化剂 |
|
|
|
|
|
学习导航
3.外界条件对化学反应速率的影响
(1)内因:参加反应的物质的_______是决定化学反应速率的主要因素。
(2)外因:
① 浓度:增大反应物的浓度,反应速率_________。固体或纯液体量的改变_______(会,不会)引起浓度的变化,_______(会,不会)引起化学反应速率的改变。
 对于反应:H2O2 + 2HI H2O + I2,在HI浓度一定时,H2O2浓度每增加一倍,反应速率就增加一倍;在H2O2浓度一定时,HI浓度每增加一倍,反应速率也增加一倍。则该反应的速率方程为:V = k______________。k称为__________,表示____________________。k越大,反应进行得______, k与浓度________(有关,无关),但受________________________等因素的影响。
对于反应:H2O2 + 2HI H2O + I2,在HI浓度一定时,H2O2浓度每增加一倍,反应速率就增加一倍;在H2O2浓度一定时,HI浓度每增加一倍,反应速率也增加一倍。则该反应的速率方程为:V = k______________。k称为__________,表示____________________。k越大,反应进行得______, k与浓度________(有关,无关),但受________________________等因素的影响。
②温度:温度是通过影响____________,而影响反应速率的。升高温度,反应速率________。 对于某一可逆反应,升高温度,正反应速率_______,逆反应速率________,改变的倍数_________(相同,不同)。升温时,平衡向_______(吸热,放热)方向移动,即吸热反应速率增大的倍数______(等于,大于,小于)放热反应速率增大的倍数。
③催化剂:是_____________________________________,是通过________________________而提高化学反应速率的。催化剂使正反应速率和逆反应速率改变的程度_______(相同,不同)。它______(能,不能)改变化学反应的平衡常数,______(能,不能)改变平衡转化率。催化剂具有选择性。
2.化学反应速率:
计算公式_______________
同一反应,用不同物质表示化学反应速率时,数值_________,但意义_____,故在应用时应指明______。用不同物质表示同一化学反应的速率,其速率之比等于__________________________。
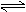 对于反应 aA + bB c C + d D,也可表示为V=______________________________。
对于反应 aA + bB c C + d D,也可表示为V=______________________________。
1. ___________________称为基元反应;___________________称为反应历程,也称为________;
___________________________称为总反应;____________________称为复杂反应。
__________和__________决定一个反应的反应历程,而反应历程的差别又造成了反应速率的不同。
4.理解化学平衡与反应速率之间的联系。
知识梳理
3.理解浓度、压强、温度和催化剂对反应速率的影响,能利用上述结论分析具体的化学反应。
2.了解反应速率的概念。掌握化学反应速率的表示方法。能用反应速率表达式进行简单的计算;理解同一化学反应速率用不同物质表示时数值不一定相同,但表示的意义相同。
1.了解化学反应分为简单反应和复杂反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com