
1.5.46×10-8mol/(L.s),快 2.(1) 向右(2)C;大于
20.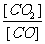 (1)增大,增大(2)否;大于;因为此时QC<KC,反应正在正向进行。
(1)增大,增大(2)否;大于;因为此时QC<KC,反应正在正向进行。
 拓展提高
拓展提高
19.(1)VA=VB;VA>VB(2)A>B(3)向右;不移动(4)不变;增大。
18.(1)加快,因为反应物H2的浓度增大了。(2)不变,因为反应物浓度未变。(3)减小,因为容器体积增大,反应物浓度减小(4)不变,因为反应物浓度未变。(5)增大,升温不管正反应吸热放热速率都增大。
17.0.025 mol·(L·S)-1;0.0125 mol·(L·S)-1;0.05 mol·(L·S)-1
12.C 13.C 14.D 15.D 16.AB
1.C 2.C 3.A 4.C 5.CD 6.BD 7.A 8.D 9.B 10.D 11.C
3.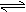 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g);△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g);△H<0
(1)写出该反应的化学平衡常数表达式K=_______________
(2)降低温度,该反应K值________,二氧化碳转化率________,化学反应速度_________(以上均填 增大、减小或不变)
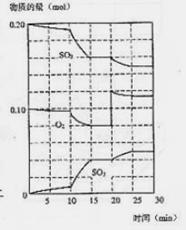 (3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____________。
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____________。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是______________________(用文字表达);
10min到15min的曲线变化的原因可能是__________(填写编号)。 A 加了催化剂 B 缩小容器体积 C 降低温度 D 增加SO3的物质的量
第3节 化学反应速率
基础训练
2. Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+
2Fe2++I2(水溶液)
Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+
2Fe2++I2(水溶液)
(1)该反应的平衡常数K的表达式为:K=____________。
当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移动(向右、向左、不)。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:V =k[I-]m[Fe3+]n
|
|
[I-](mol/L) |
[Fe3+] (mol/L) |
V (mol/L·s) |
|
1 |
0.20 |
0.80 |
0.032κ |
|
2 |
0.60 |
0.40 |
0.144κ |
|
3 |
0.80 |
0.20 |
0.128κ |
通过所给的数据计算:在V =k[I-]m[Fe3+]n中,m、n的值为 A.m=1,n=1 B. m=1,n=2 C. m=2,n=1 D. m=2,n=2
I-浓度对反应速度的影响 Fe3+浓度对反应速度的影响。(选填:小于、大于、等于)
1. 丙酮和碘在酸性溶液中发生以下反应:CH3COCH3
+ I2 CH3COCH2I
+ H+ + I-。25℃时,该反应速率由下列经验式决定V = k[CH3COCH3][ H+],式中,k = 2.73×10-5mol/(L.s)。25℃时,已知反应开始时C(I2)=0.01mol/L,C(CH3COCH3)=0.1mol/L,C(H+)=0.02mol/L。求:
丙酮和碘在酸性溶液中发生以下反应:CH3COCH3
+ I2 CH3COCH2I
+ H+ + I-。25℃时,该反应速率由下列经验式决定V = k[CH3COCH3][ H+],式中,k = 2.73×10-5mol/(L.s)。25℃时,已知反应开始时C(I2)=0.01mol/L,C(CH3COCH3)=0.1mol/L,C(H+)=0.02mol/L。求:
(1)反应开始时的速率_____________。
(2)当溶液中的I2反应掉一半时,反应速率比开始时慢还是快?为什么?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com