
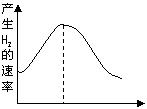
19(6分)(1)把镁条投入盛有盐酸的敞口容器中,产生氢气速率
变化如图所示。在反应过程中导致速率变化的因素有
①H+的浓度②镁条的表面积③溶液的温度④Cl-的浓度
(2)影响速率的有关因素有:物质本身的性质、浓度、温度、催化剂等方面,依据影响速率的有关因素分析下列问题:
①Mg和Fe均可以与O2反应, Mg在空气中可以点燃, Fe在空气中不能点燃,是由于 的影响;
②Fe在空气中加热不能燃烧,但在纯氧中可以,是由于 的影响;
20(10分)(1)相同温度时,向两个开始体积相同的容器中分别充入2molSO2和1molO2,甲容器保持恒压,乙容器保持恒容,达到平衡时:(填“大于“小于”“等于”)
反应速率v甲_____ v乙,SO2的转化率ω甲_____ω乙,所需时间t甲____t乙。
 (2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
(2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
I2的浓度c(I2)A____c(I2)B, ,I2蒸气在混合气体中的体积分数A容器_ _B容器
21(8分)把煤作为燃料可通过下列两种途径:
|
途径Ⅰ:C(s)+O2(g) === CO2(g) (1mol碳单质反应放热Q1 kJ)
途径Ⅱ:先制水煤气
|
C(s)+H2O(g)===CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
再燃烧水煤气
|
|
 2CO(g)+O2(g) === 2CO2(g)
2CO(g)+O2(g) === 2CO2(g)
2H2(g)+O2(g) =2H2O(g)
试回答下列问题:
(1)当等物质的量的单质碳反应时,途径Ⅰ放出的热量_________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
 (2)Q1
、Q2 、Q3 的数学关系式是__________________。
(2)Q1
、Q2 、Q3 的数学关系式是__________________。
(3)由于制取水煤气反应是吸热反应,所以反应物所具有的总能量________(填“大于”、“等于”或“小于”)生成物所具有的总能量。
(4)简述煤通过途径Ⅱ作为燃料的意义: 。
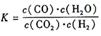 22(12分)某反应的平衡常数表达式为
,恒容时,温度升高.H2浓度减小。分析下列问题:
22(12分)某反应的平衡常数表达式为
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
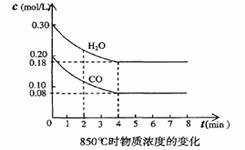 (3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K=
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K=
(4)850℃时,在相同容器中发生反应CO2+
H2  CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09
mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09
mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时
v(正) v(逆)(“大于”“ 小于”“等于”)
23(10分)已知:合成氨反应为N2+3H2
 2NH3(正反应为放热反应),分析下列问题:
2NH3(正反应为放热反应),分析下列问题:
(1)在一定温度时,可用图中哪一条曲线表示反应物的转化率和压强之间的关系 (填“I”“II”“III”)


(2)在不同温度和压强下(P1>P2),合成氨反应达到平衡时,混合气体中氨气的体积分数Z%
随温度变化的曲线应为 (填“A”“B”“C”“D”)
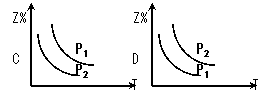
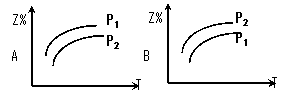
(3)将N2和H2按1:3的体积比通入合成塔,反应达平衡后,NH3的体积分数为20%,则达到平衡时,N2和H2的转化率之比α(N2)∶α (H2)= ;平衡时N2的转化率为_________;平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 九江一中高二年级第一次月考化学试卷
第II卷(46分)
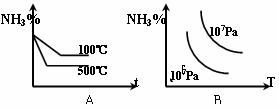
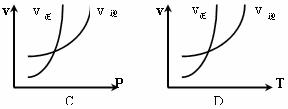
18、对于反应:N2+3H2  2NH3(正反应为放热反应),下列图象所示不正确的是( )
2NH3(正反应为放热反应),下列图象所示不正确的是( )
九江一中高二年级第二次月考化学试卷
17、人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力CO吸入肺中发生反应:CO+HbO2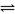 O2+HbCO
,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
( )
O2+HbCO
,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
( )
A.CO与HbO2反应的平衡常数K=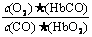
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
16、已知一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量。在同温同压下向密闭容器中通入1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.5molN2和1.5molH2,相同温度下达到平衡时放出热量为Q2kJ。则下列叙述正确的是 ( )
A.2Q2>Q1=92.4kJ B.2Q2=Q1=92.4kJ C.2Q2<Q1<92.4kJ D.2Q2=Q1<92.4kJ
15、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
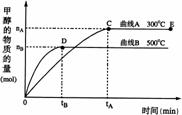 (催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)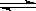 CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 (
)
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 (
)
A.反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B.升高温度,K值增大
C.在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB /2nB mol·(L·min)-1
D.其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
14、下列说法或表示方法正确的是 ( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s) △H=-1.90 kJ/mol可知,金刚石比石墨稳定
C.氢气的燃烧热285.8kJ/mol,氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=+285.8 kJ/mol
D.在稀溶液中H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol若将含0.5 mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ
13、一定量混和气体在密闭容器中发生如下反应mA(g)+nB(g) pC(g),达平衡后,保持温度不变,将容器的容积缩小到原来的1/2,达到新的平衡时,C的浓度为原来的1.9倍,下列说法正确的是 ( )
pC(g),达平衡后,保持温度不变,将容器的容积缩小到原来的1/2,达到新的平衡时,C的浓度为原来的1.9倍,下列说法正确的是 ( )
A.m+n>p B.A的转化率变大 C.平衡向左移动 D.C的百分含量增加
12、已知:4NH3+5O2 4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) [mol·L-1·min-1]表示,则下列关系正确的是 ( )
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) [mol·L-1·min-1]表示,则下列关系正确的是 ( )
A.υ(NH3)=υ(O2)=υ(NO)=υ(H2O) B. υ(NH3):υ(O2):υ(NO):υ(H2O)= 4:5:4:6
C.υ(NH3)= 3/2υ(H2O) D.5υ(O2)=6υ(H2O)
11、1×105Pa、298K时,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g) = H2(g) + 1/2O2(g) △H= +242kJ·mol-1
B.2H2(g) + O2(g) = 2H2O(l) △H= +484kJ·mol-1
C.H2(g) + 1/2O2(g) = H2O(g) △H= +242kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H= +484kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com