
1.二次函数的三种表达式:
一般式: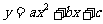 顶点式:
顶点式: ;
;
零点式:
4. 会运用数形结合、分类讨论、函数与方程以及等价转化等重要的数学思想分析解决有关二次的问题。
3. 会讨论二次方程实根分布和二次不等式的解;
2. 掌握一元二次函数、方程、不等式的关系;
1. 掌握二次函数的图象和性质;
2.分散系的比较
|
分散系 种类 |
溶液 |
胶体 |
浊液 |
|||
|
水溶液 |
非水溶液 |
粒子胶体 |
分子胶体 |
悬浊液 |
乳浊液 |
|
|
分散质粒子 |
离子或分子 |
分子 |
分子或离子的集合体 |
大分子 |
巨量分子集合的颗粒 |
巨量分子集合的液滴 |
|
举例 |
食盐水 |
碘酒 |
Fe(OH)3胶体 |
淀粉溶液 |
石灰乳 |
牛奶 |
|
分散质粒子直径⑴ |
1n m |
1nm-100n m |
100n m |
|||
|
均一性⑵ |
|
|
|
|||
|
稳定性⑶ |
|
|
久置沉降 |
久置分层 |
||
|
能否通过滤纸⑷ |
|
|
|
|||
|
能否通过半透膜⑸ |
|
|
|
|||
|
有无丁达尔效应⑹ |
|
|
- |
试题枚举
[例1]右图是M、N两种不含结晶水的固体物质的溶解度曲线。下列说法中正确的是
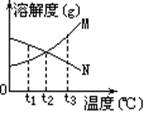 A.t1℃时,N比M的溶解度大
A.t1℃时,N比M的溶解度大
B.温度从t1℃升高到t3℃时,N的饱和溶液中溶质的质量分数将增大
C.M比N的溶解度大
D.N中含有少量M时,可用降温结晶法提纯N
解析:由图可看出,t1℃时N比M的溶解度大, A正确。因N的溶解度随温度的升高而降低,故从t1℃升高到t3℃时N的饱和溶液中溶质的质量分数将减小, B错。温度高于t2℃时M的溶解度大于N,温度低于t2℃时,M的溶解度小于N, C错。N中含有少量M时,可用升温结晶法提纯N,D错。
答案: A
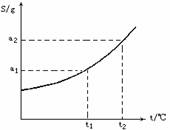 [例2]摩尔质量为M g/mol的某物质的溶解度曲线如图所示,现有t2℃
300g该物质的溶液,在温度不变时蒸发掉50 g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ g/mL,则饱和溶液的物质的量浓度为____mol/L,若将此饱和溶液降温至t1℃时,析出无水物晶体的质量为______g。
[例2]摩尔质量为M g/mol的某物质的溶解度曲线如图所示,现有t2℃
300g该物质的溶液,在温度不变时蒸发掉50 g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ g/mL,则饱和溶液的物质的量浓度为____mol/L,若将此饱和溶液降温至t1℃时,析出无水物晶体的质量为______g。
解析:由溶解度曲线可知,在t2时,该物质的溶解度为a2g,
饱和溶液的溶质质量关分数可用下式计算: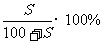
再根据物质的量浓度和溶质质量分数的换算公式,求出溶液的物质的量浓度。
由t2℃的溶解度数据可求出溶液的溶质质量分数
=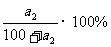 。
。
溶液的物质的量浓度=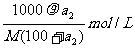
设降温至t1时,析出的晶体的质量为χ
根据公式:100+S(高温)∶S(高温)-S(低温)=高温下饱和溶液质量∶析出晶体质量
(100 +a2)∶(a2-a1)=(300-50)∶χ
χ=250(a2-a1)/(100+a2)g
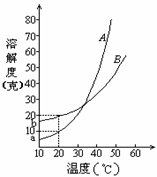 [例3]A、B两种化合物的溶解度曲线如右图。现要用结晶法从A、B混和物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取50克混和物,将它溶于100克热水,然后冷却至20℃。若要使A析出而B不析出,则混和物中B的质量百分比(B%)最高不能超过多少?(写出推理及计算过程。)
(2)取W克混和物,将它溶于100克热水,然后冷却至10℃。若仍要使A析出而B不析出,请写出在下列两种情况下,混和物中A的质量百分比(A%)应满足什么关系式。(以W、a、b表示。只需将答案填写在下列横线的空白处.)
当W<a+b时,A%
[例3]A、B两种化合物的溶解度曲线如右图。现要用结晶法从A、B混和物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取50克混和物,将它溶于100克热水,然后冷却至20℃。若要使A析出而B不析出,则混和物中B的质量百分比(B%)最高不能超过多少?(写出推理及计算过程。)
(2)取W克混和物,将它溶于100克热水,然后冷却至10℃。若仍要使A析出而B不析出,请写出在下列两种情况下,混和物中A的质量百分比(A%)应满足什么关系式。(以W、a、b表示。只需将答案填写在下列横线的空白处.)
当W<a+b时,A%
当W>a+b时,A% 。
解析:(1)因为在20℃时,A的溶解度为10g,B的溶解度为20g,所以50gA和B的混合物溶于100g热水中,降温至20℃时,要使B不析出,A能析出,则在50g混合物中,B的质量应≤20g,A的质量应≥30g,即在50g混合物中B的质量分数应≤40%。
(2)要使B不析出,B的质量≤b,而A要析出,A的质量应>a。当W<a+b时,只要A>a,即可满足条件,所以A%>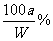 。当W>a+b时,B≤b即可满足条件,所以A%≥
。当W>a+b时,B≤b即可满足条件,所以A%≥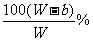
[例4]氯化铁溶液和氢氧化铁胶体具有的共同性质是( )
A.分散系颗粒直径都在1~100nm之间
B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成
D.呈红褐色
解析:溶液中溶质颗粒直径都小于1nm,胶体中胶粒直径都在1~100 nm之间,前者能透过半透膜,后者不能透过半透膜。加热蒸干时,氯化铁水解为氢氧化铁,灼烧后,氢氧化铁分解为氧化铁,氧化铁溶液呈棕黄色,氢氧化铁胶体呈红褐色。
答案:C
1.概念:一种或几种物质分散到另一种物质中形成的混合物叫做分散系。被分散的物质叫做 ,物质分散于其中的物质叫做 。
3.胶体的制备:将少量饱和的氯化铁溶液加入沸水中,可制备氢氧化铁胶体。反应方程式如下: 。
思考:各举一例说明胶体特性的应用:
(1)丁达尔效应 (2)电泳现象
(3)不能透过半透膜 (4)吸咐性
2.胶体的性质:胶体的性质主要为 运动、 现象和 。
1.胶体的概念:分散质直径在 之间的分散系。胶体粒子不能通过 ,但能通过 。所以分离胶体与溶液的方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com