
6. 某金属能跟稀盐酸作用生成氢气,该金属与锌组成原电池时,锌为负极,
此金属是
A. Mg B. Fe C. Al D. Cu
5. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为( )
A. X > Y > Z B. X > Z > Y
C. Y > X > Z D. Y > Z > X
4. 已知空气-锌电池的电极反应为:
锌片: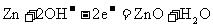
石墨: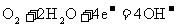
根据此判断,锌片是( )
A. 负极,并被氧化 B. 负极,并被还原
C. 正极,并被氧化 D. 正极,并被还原
3. 将锌片和铜片用导线连接于同一稀硫酸溶液中。下列叙述正确的是( )
A. 正极附近硫酸根离子的浓度逐渐增大
B. 负极附近硫酸根离子的浓度逐渐增大
C. 正极、负极硫酸根离子的浓度基本不变
D. 正极附近硫酸根离子的浓度逐渐减少
2. 实验室中制取氢气,最好的方法是( )
A. 纯锌与稀硫酸反应 B. 纯锌与浓硫酸反应
C. 纯锌与稀盐酸反应 D. 粗锌(含铜、银)与稀硫酸反应
1. 铜片和锌片用导线连接后插入稀硫酸中,锌片是( )
A. 阴极 B. 正极 C. 阳极 D. 负极
2. 原电池的原理
负极----较活泼的金属--- 电子------发生 反应
正极----较不活泼的金属---- 电子----发生 反应
试题枚举
[例1]下列叙述中正确的是
A.构成原电池正极和负极的材料必须是两种金属。
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极。
C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀。
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4mol电子通过。
解析: 两种活动性不同的金属与电解质溶液能够组成原电池,但不能因此说构成原电池电极的材料一定都是金属,例如锌和石墨电极也能跟电解质溶液组成原电池。在原电池中,活动金属中的电子流向不活动的电极,因此活动金属是负极。镀锡铁表皮破损后与电解质溶液组成原电池,铁较锡活泼,铁先失电子被腐蚀。铜锌原电池工作时,锌负极失电子,电极反应为Zn –2e==Zn2+,1molZn失去2mol电子,0.2mol锌(质量为13克)被溶解电路中有0.4mol电子通过。故选D。
答案:D
[例2]把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
解析:金属组成原电池,相对活泼金属失去电子作负极,相对不活泼金属作正极。负极被氧化质量减轻,正极上发生还原反应,有物质析出,由题意得活泼性 A>B、A>C、C>D 、D>B,故正确答案为B。
答案:B
[例3]电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是: Zn + 2 OH- -2e=ZnO + H2O Ag2O +H2O + 2e=2Ag +2 OH-
下列判断正确的是
A.锌为正极,Ag2O为负极。 B.锌为负极,Ag2O为正极。
C.原电池工作时,负极区溶液PH减小。 D.原电池工作时,负极区溶液PH增大。
解析:本题考查原电池和PH的概念。
原电池中失去电子的极为负极,所以锌为负极,Ag2O为正极。B是正确答案。因为 Zn + 2 OH- -2e=ZnO + H2O ,负极区域溶液中[OH-] 不断减少,故PH减小,所以C也正确。故选B、C。
答案:BC
[变式]化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,
以下说法中正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2).废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
。
(3).另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2→LiMnO2试回答:锂电池比容量特别大的原因是 。锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因 。
答案:(1)B (2)Ni(OH)2和Cd(OH)2能溶于酸性溶液。
(3)锂的摩尔质量小;2Li+2H2O→2LiOH+H2↑
2.能正确书写原电池的正、负极的电极反应式及电池反应方程式。
知识梳理
1:组成原电池的条件。
① 有两种活性不同的金属(或一种是非金属导体)。
② 电极材料均插入电解质溶液中。
③ 两电极相连形成闭合电路。
1.通过进行化学能转化为电能的探究活动,了解原电池工作原理.
21. (10分)
(10分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com