
2.合成氨生产工艺:生产流程 。
原料气的制备 。其中生产的氨气液化分离,原料气循环利用。
1. 合成氨的条件的选择:温度 压强
催化剂
3.海水的淡化的概念 。淡化的方法有蒸馏法、电渗析法、反渗透法、冷冻法。蒸馏法的主要特点 ,原理
。电渗析法的基本原理 ,
特点 。
2.硬水软化的方法有药剂软化法和离子交换法。离子交换法的原理是
特点是 。离子交换树剂的组成 ,类型 。
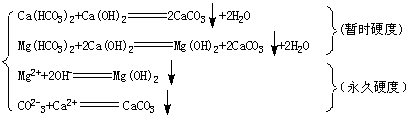 石灰--纯碱法
石灰--纯碱法
磺化煤对硬水的软化及自身的再生过程:
 软化:2NaR+Mg2+ MgR2+2Na+
软化:2NaR+Mg2+ MgR2+2Na+
 2NaR+Ca2+ CaR2+2Na+
2NaR+Ca2+ CaR2+2Na+
再生:将已用过的磺化煤浸泡在8%-10%的食盐水中。
1.硬水是 水的硬度通常用
表示。水的硬度有暂时硬度和永久硬度两种。暂时硬度的水指 ,对其常采用 的方法软化,反应的方程式为
。永久硬度的水常含有 等离子。
2.污水处理:(1)污水中的主要污染物: 。
(2)污水处理的主要方法: 。
水的“DO”指 “BOD”指 “中水”指
1.生活用水的净化:(1)净化的含义: 。
天然水中所含的杂质有 。(2)混凝剂: ,
常见种类 。净水原理
。
(3)常用作水消毒杀菌的药剂: 。
自来水生产流程 :
。
2.(12分) 软锰矿的主要成分为: MnO2含量≥65%、Al2O3含量为4%;闪锌矿的主要成分为:ZnS含量≥80%、FeS、CuS、CdS含量各为2%。
生产二氧化锰和锌的新工艺主要是通过电解获得二氧化锰和锌,副产品是硫、金属铜和镉。简化流程框图如下(中间产物的固体部分已经略去),已知部分金属活动性:Mn>Zn>Cd>Fe。
软锰矿、闪锌矿 滤液A
滤液A Zn2+、Mn2+、Fe2+、Al3+
Zn2+、Mn2+、Fe2+、Al3+
ZnSO4、MnSO4溶液 Zn+MnO2+产品D
Zn+MnO2+产品D
试回答下列问题:
(1)在新工艺中软锰矿、闪锌矿粉末与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中和CuS发生氧化-还原反应的化学方程式:____________________。
(2)在新工艺中加入适量金属B,可以回收金属Cu和Cd,考虑到整个生产,B应选用的金属为_________:①Zn ②Fe ③Cd ④Mn
(3)在新工艺中加入C物质(2种物质的混合物),把滤液B中的Fe2+、Al3+以Fe(OH)3和Al(OH)3沉淀除去而得到纯净的ZnSO4、MnSO4溶液。则C可以为_______(任选一种可能的组合)。
①MnO2 ②MnCO3 ③ZnCO3 ④ZnO
(4)电解制备MnO2时,阳能极材可能为____________。电解产品D对整个生产有什么意义________________________________________。
(5)电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池中析出。锌的传统生产工艺为:闪锌矿高温氧化脱硫再还原得粗锌:2ZnS+O2 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 2CO ZnO+CO
2CO ZnO+CO Zn(g)+CO2。将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。试从环境保护和能量消耗的角度评价新工艺有哪些优点。_____。
Zn(g)+CO2。将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。试从环境保护和能量消耗的角度评价新工艺有哪些优点。_____。
1.碱式碳酸铜[CuCO3·Cu(OH)2,Mr=222]为草绿色或绿色结晶物,不溶于水,分解温度220℃,在100℃的水中易分解,是具有广泛用途的化工产品。甲同学以纯碱和胆矾为原料制备制备碱式碳酸铜:分别称取28g胆矾晶体(Mr=250)和16g纯碱晶体(Mr=286),分别研细后再混合研磨,观察到有气泡产生,并形成胶状物。将胶状物迅速投入200mL沸水中并快速撤离热源,产生蓝绿色沉淀,过滤、洗涤至不含Na2SO4,烘干,得产品9.9g。乙同学以Cu(NO3)2、NaOH、Na2CO3为原料制备碱式碳酸铜,并探究最佳反应条件。不同反应条件下的实验记录如下:
表1:不同比例各物质的量对反应产物的影响
|
V(NaOH,c=0.5mol/L)/mL |
V(Na2CO3,c=0.25mol/L)/mL |
V[Cu(NO3)2,c=0.5mol/L]/mL |
产率(%) |
产品 品质 |
反应结束 时的pH |
|
10 |
16.7 |
10 |
76.6 |
颗粒细 |
9.0 |
|
10 |
12.5 |
10 |
78.9 |
颗粒细 |
8.5 |
|
10 |
10.0 |
10 |
85.5 |
颗粒大 |
8.5 |
|
10 |
8.3 |
10 |
85.7 |
颗粒大 |
9.0 |
|
10 |
7.2 |
10 |
85.8 |
颗粒大 |
9.0 |
表2:温度对反应产物的影响(取反应物最佳配比)
|
t/℃ |
产率(%) |
产品品质 |
反应结束时的pH |
|
25 |
85.2 |
颗粒细 |
8-9 |
|
40 |
85.3 |
颗粒细 |
8-9 |
|
50 |
85.
3 |
颗粒细 |
8-9 |
|
60 |
85.8 |
颗粒大 |
8-9 |
|
80 |
85.1 |
颗粒大 |
8-9 |
回答下列问题:
⑴ 甲同学的实验中用到的玻璃仪器除研钵、三角漏斗、烧杯、酒精灯外,还有 ;
⑵ 甲同学的实验中说明产品中不含Na2SO4的实验事实是 ;
⑶ 甲同学的实验中,若产品为纯净的碱式碳酸铜,则产率为 ;
⑷ 依据乙同学的实验记录,Cu(NO3)2、NaOH、Na2CO3为原料制备碱式碳酸铜的最佳实验条件为 。
⑸ 甲、乙两同学的实验相比,乙同学的实验方案具有的优势有
(至少回答两点)。
19.实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2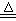 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题: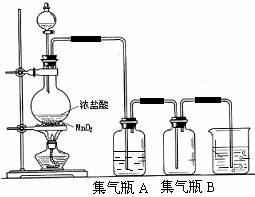
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用
溶液来吸收有毒的氯气。
(4)一次实验中,用浓盐酸80mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了5.6L(STP)的氯气。试计算浓盐酸的物质的量浓度和被氧化的HCl的物质的量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com