
(2)3CuO+2NH3 △ 3Cu+N2+3H2O (2分)
(2)氢氧化钠固体(或生石灰或碱石灰) (2分)
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:
取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。
据此可推得A为 ,由此得到的结论是 。
答案:
 该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 。
(2)实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
酸性的化学肥料不能和碱性肥料混用,如硝酸铵和草木灰(主要有效成分为K2CO3)不能混合施用,因NH4NO3水解是酸性,K2CO3水解是碱性,混合促进水解,降低肥效。
试题枚举
[例1]2000年诺贝尔物理学奖授予为现代信息技术作出贡献的三位科学家,表彰他们为信息技术所作的基础性研究,特别是他们发明的快速晶体管、激光二极管和集成电路芯片。与该项奖相关的基础知识,下列说法错误的是:
A 晶体管由半导体材料制成
B 二极管具有电流放大作用
C 集成电路使电子设备小型化,功能多样化
D 现代信息技术的发展与物理学新发现密切相关
解析:本题结合2000年物理学奖的奖项内容,设置了与中学知识相关的四个选项,考查考生对半导体。激光二极管、集成电路和信息技术等知识的理解能力和判断能力。由于二极管具有单向导电性,不具备电流放大作用,故选项B错误。
答案:B
[例2]录像用的高性能磁带的磁粉,主要材料之一是由三种元素组成的化学式COxFe3-xO3+x的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物每种元素都只有一种化合价,则x值为____________,铁的化合价为____________,钻的化合价为____________。
解析:本题有三个未知量,只能根据化合价规则建立一个方程,但一个方程中有三个未知数,要解这个方程必然要联系化学含义。设化合物中钴的化合价为a价,铁的化合价为b价,根据化合物中各元素的化合价代数和为零的原则,可建立如下方程:ax+b(3-x)-2(3+x)=0,整理得x=(3b-6)/(b+2-a)。依题意,b只能取2或3,当b=2时,无意义,故b只能取3,此时x=3/(5-a),仅当a=2时,x=1(整数)有意义。
答案:X为2,铁的化合价为3,钴的化合价为2。
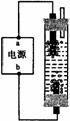 [例3]某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
[例3]某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A a为正极,b为负极;NaClO和NaCl
B a为负极,b为正极;NaClO和NaCl
C a为阳极,b为阴极;HClO和NaCl
D a为阴极,b为阳极;HClO和NaCl
解析:本题从电极名称和电解后溶液的主要成分两方面进行设问。首先,a、b电极为电源上的电极,原电池的电极名称与电解池的电极名称不同,应为正极或负极,排除选项C和D。其次,如图所示的电解池中,要使Cl2能被溶液“完全吸收”,是让上边一个电极产生Cl2 ,还是让下边一个电极产生Cl2 ?让阳极产生的Cl2通过阴极附近的碱溶液,Cl2 才能被完全吸收。第三,电解池中产生Cl2的阳极对应的电源电极名称是正极。
答案:B
[例4]某工厂用氨氧化法可制得质量分数为50%的硝酸,脱水后可进一步得到90%的硝酸,若以17t液氨为原料生产硝酸(假设反应及脱水过程中各反应物及生成物均无损耗)。试填写下列空白。
(1)若该厂只生产50%的硝酸,计算得到的理论上需水的质量为 t。
(2)若该工厂只生产90%的硝酸,计算理论上需水质量 t。
(3)若该厂同时生产50%和90%两种硝酸,它们的质量比为
x=m1/m2(m1、m2分别表示50%,90%硝酸的质量)
①写出理论所需水量y与质量比x的函数关系式y= 。
②当进出水量平衡时x= ,此时,两种产品的总质量为 。
 解答: (1)NH3+2O2 HNO3+H2O
解答: (1)NH3+2O2 HNO3+H2O
17g 63g 18g
17t x′t y′t
得m=63t n=18t
则补加水at:
50%·(a+18+63)=63
得a=45t
(2)设补加水bt:
则90%·(b+18+63)=63
得b=-11t(即脱水11t)


 (3)①
(3)①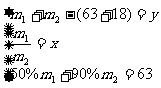
得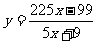
②当进出水平衡时,即不需补加水,即 y=0
代入上式得 x=11∶25
将 y=0 代入上述①式
m1+m2=81
得:两种产品总质量为81t
|
三阶段 |
SO2制取和净化 |
SO2转化为SO3 |
SO3吸收和H2SO4的生成 |
|
三方程 |
|
|
|
|
三设备 |
|
|
|
|
有 关 原 理 |
矿石粉碎,以增大__ __________________________________ |
逆流原理(热交换器中:管___ ___气体__,管_____气体__)目的:冷气预热至_____℃以上,热气冷却至____℃以下. |
逆流原理(浓硫酸____,气体____)增大接触面积(吸收塔内入填料)以充分吸收。 |
|
设备中排出的气 体 |
炉气:SO2.N2.O2.矿尘(除尘).砷硒化合物(洗涤). H2O气(干燥)…… 净化气:SO2.N2.O2 |
|
尾气:
不能直接排入大气中 |
|
说 明 |
矿尘.杂质:易使催化剂“中毒” H2O气:腐蚀设备、影响生产 |
接触室内压强为____压。 为什么?__________ |
实际用___________吸 收SO3,以免形成___ |
3.离子交换膜法制烧碱
离子交换膜的特性:只允许阳离子通过,而阻止阴极离子和气体通过。
2.饱和食盐水的精制:电解前应除去食盐溶液中的Ca2+、Mg2+、SO42―等杂质离子,加入试剂依次为NaOH溶液、BaCl2溶液、Na2CO3溶液、稀盐酸(或将BaCl2溶液和NaOH溶液的顺序互换)。
离子交换膜电解槽主要由阳极(用金属钛网制成,涂有钛、钌等氧化物涂氯碱工业--电解饱和食盐水制取氯气和烧碱。
1.原理:阳极(用石墨):2Cl― -2e-=Cl2 ↑ 阴极(用Fe):2 H+ + 2e-= H2 ↑
总反应:2NaCl + 2 H2O
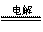 2NaOH
+H2↑+Cl2↑
2NaOH
+H2↑+Cl2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com