
4.氧化还原反应的典型计算:依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。
3.配平氧化还原反应方程式,判断氧化还原反应电子转移的方向和数目。
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数
方法步骤:划好价、列变化、求总数、配系数。
2.氧化还原反应规律,氧化性或还原性强弱比较规律。在同一氧化还原反应中,氧化性强弱顺序:氧化剂 > 氧化产物 ; 还原性强弱顺序:还原剂 > 还原产物
1.氧化和还原、氧化性和还原性、氧化剂和还原剂等概念。元素处于最高价,只有氧化性;处于最低价时,只有还原性;处于中间价态时,既有氧化性又有还原性。概念可简记为“升-失-氧-还;降-得-还-氧”再进行理解。
23.(1)2:5 (2)7mol/L (3) 1:3
(4)5Fe+14HNO3=5Fe(NO3)2+NO2↑+3NO↑+7H2O
22.(1)0.5mol (2)4/6 × 0.5mol = 1/3 mol
(3)1/6 mol
0.2mol NH3和0.8mol NO
21.(1)
(2)6mol NO 还原得到3mol N2 ,4mol NH3氧化得到2mol N2 ,两者相差1molN2.现相差1.4g,1.4g÷28gmol-1=0.05mol,相当于0.3molNO和0.2molNH3反应。
依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,所以有两种情况:0.3molNO和0.7mol NH3
20.(1)KIO3 0.5 (2) ①
(3) SO32- SO32-的还原性大于I-,SO32-优先被氧化。
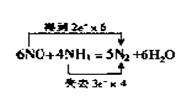

19.(1)Cl-、Br- 0.10 mol
(2)0.25 mol n( Fe3+)=0.50mol/L
(3)Cl2> Br2> Fe3+> I2
(4) I2+5 Cl2+6H2O=2IO3-+10Cl-+12H+ 0.8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com