
4、用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1.4 g乙烯和丙烯的混合物中含碳原子数为0.2NA
B.标准状况下,2.24LNO与N2的混合气中所含分子总数为0.1NA
C.常温常压下,1 molD3O+中所含中子数为10NA D.7.8gNa2O2晶体中含有0.2NA个阴离子
3、分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
2、下列混合物的分离和提纯方法中,不是从溶解性的角度考虑的是( )
A.重结晶 B.蒸馏 C.过滤 D.萃取
1、2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为: ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A.奥运火炬燃烧主要是将化学能转变为热能和光能B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol
23.将10g铁粉置于40mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792L标准状况下的混合气体(NO2、NO),溶液里还残留4.4g固体。
(1)求该反应中被还原的硝酸与未被还原的硝酸的质量比。
(2)求理论上原硝酸的物质的量浓度。
(3)求混合气体中NO2、NO的体积比。
(4)写出上述反应的总的化学方程式。
22.将铝放入烧碱溶液中,若反应过程中有0.5mol电子转移,求:(1)参加反应的水的物质的量为多少?
(2)生成水的物质的量为多少?
(3)反应总耗水的物质的量为多少?
21.在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
20.亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是 Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O(未配平)
(1)其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘的物质的量为 mol。
(2) 该反应过程和机理复杂,一般认为分以下几步:
①IO3-+SO32-→ IO2-+SO42-(反应慢)
②IO2-+2SO32-→ I-+2SO42-(反应快)
③5I -+6H++IO3-→ 3I2+3H2O(反应快)
④I2+SO32-+H2O→ 2I-+SO42-+2H+(反应快)
根据上述条件推测,此反应速率由 步反应决定。(填序号)
(3)若预先加入淀粉溶液,由反应过程看,必在 离子消耗完时才会有使淀粉变蓝的现象产生,原因是
。
19.已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200mL混合溶液中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是 ,剩余Fe2+的物质的量为 。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为 ,若最终所得溶液为400mL,其中主要阳离子及其物质的量浓度为 。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是 。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式 ,
上述所有反应共消耗Cl2 mol。
18.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
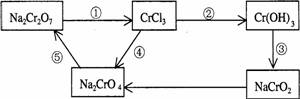
(l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□ Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com