
2.参照系
(1)概念:为了研究物体的运动而预先假定不动的物体。
(2)问题:同一个运动,如果选不同的物体作参考系,观察到的运动情况是否相同?参考系的选取原则上是任意的,但在实际问题中,以研究问题方便、对运动的描述尽可能简单为原则;同一物体的运动,选择不同参考系观察的结果是否相同?
(3)例题
甲、乙、丙三人各乘一架直升飞机沿竖直方向运动,甲看到楼房匀速上升;乙看到甲机匀速上升;丙看到乙机匀速下降;甲看到丙机匀速上升。那么,甲、乙、丙相对地面的运动情况可能是( )
A.甲、乙匀速下降,且v乙>v甲,丙停在空中
B.甲、乙匀速下降,且v乙>v甲,丙匀速上升
C.甲、乙匀速下降,且v乙>v甲,丙匀速下降,且v丙<v甲
D.甲、乙匀速下降,且v乙>v甲,丙匀速下降,且v丙>v甲
(4)练习题
1.质点
(1)定义 在研究物体的运动时,不考虑物体的大小和形状,而把物体看作一个有质量的点,这个用来代替物体的有质量的点叫做质点
(2)问题:是否大的物体一定不能看成质点,小的物体一定可以看成质点?试讨论物体可看作质点的条件:
(3)例题:
下列关于质点的说法中正确的是 ( )
A.体积很小的物体都可看成质点
B.质量很小的物体都可看成质点
C.不论物体的质量多大,只要物体的尺寸跟物体间距离相比甚小时,就可以看成质点
D.只有低速运动的物体才可看成质点,高速运动的物体不可看做质点
(4)练习题
下列有关质点的描述中,正确的是 ( )
A.原子核很小,一定能看做质点
B.地球很大,一定不能看做质点
C.在太空中,进行飞船对接的宇航员观察这个飞船时,能把飞船看做质点
D.从地球上的控制中心跟踪观察在太空中飞行的宇宙飞船时,能把飞船看做质点
|
实验序号 |
KClO3的质量/g |
A的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.0 |
2.0 |
500 |
|
|
2 |
8.0 |
2.0 |
500 |
|
请回答:上述实验中的待测数据应是 ;
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:
。
II、已知下列化学反应:2H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 5O2↑+ MnSO4 + 8H2O。某化学研究性学习小组在做此实验时发现:在敞口容器中, 当H2O2与酸化的KMnO4 溶液混合时,开始放出氧气的速率很慢,一段时间后产生氧气的速率很迅速,经过测定发现溶液中温度变化不大,学生百思不得其解,经向老师询问,老师说:影响化学反应速率的外界因素有浓度、温度、压强和催化剂,现随着反应的进行,反应物的浓度在逐渐降低,敞口容器的压强不受影响,反应的温度变化不大,则可能的因素是催化剂的影响。在老师的提示下学生又做了三个对比实验如下:
(1)空白实验
(2)起始时加入少量K2SO4固体
(3)起始时加入少量MnSO4固体
(4)起始时加入少量水
结果发现(1)、(2)起始反应速率差不多,(4)的起始反应速率比(1)、(2)慢,(3)的起始反应速率很快。请解释(1)实验中反应速率的变化现象的原因是: ________________________________ __。
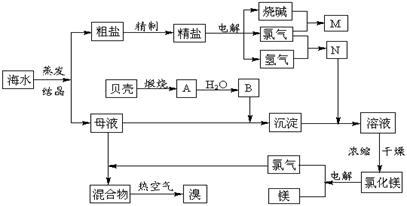
21、(10分)海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
请回答:
(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为____。
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(2)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是 。
 (3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 。
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 。
A.精制饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
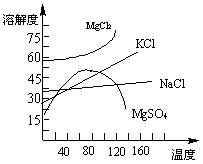
(4)母液中常含有MgCl2、NaCl、MgSO4、KCl等,
可进一步加工制得一些重要的产品。若将母液加热升
温到60℃以上,随着水分的蒸发,会逐渐析出晶体,
此晶体的主要成分是__________________;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的 晶体。
|
实验序号 |
KClO3的质量/g |
MnO2的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.0 |
2.0 |
500 |
|
|
2 |
8.0 |
2.0 |
500 |
|
20、(6分)大约有85%化学反应需要用催化剂,催化剂研究是二十一世纪化学研究的重要课题之一。
I、某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均在500℃左右。于是对A和二氧化锰的催化性能进行了定量对照实验,实验时均以收满500mL氧气为准(其他可能影响实验的因素均可忽略)。
19、(12分)无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
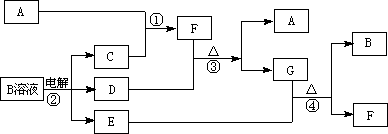
(1)写出化学式A ,D ,F ,写出电子式G ;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、
。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。
18、(13分)工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
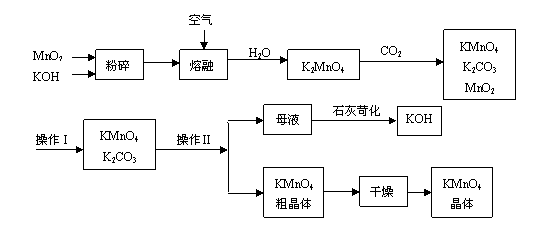

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有 、 (写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) 。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
17、(13分)有一包含有氧化镁的碳酸钙粉末,某课外活动小组通过实验,用测定氧化镁质量的方法测定混合粉末中碳酸钙的质量分数。请你根据他们设计的下列操作步骤进行补充,并回答有关问题。
①称取3.3g样品放入锥形瓶中,缓慢滴入60mL3.0mol/L的盐酸。滴加盐酸过程中,锥形瓶内可观察到的现象是 。
②加入 。
③称量一张滤纸(其质量为W1g)安装过滤器,过滤。过滤时,某同学操作不慎,使漏斗里的液体的液面高于滤纸的边缘,该同学发现后,应采取的措施是 。
④ ,目的是 。
⑤取滤渣连同滤纸放在坩埚内进行干燥与灼烧至恒重W3g(已知坩埚的质量为W2g),滤渣经灼烧后,固体物的成分(不考虑滤纸灰)是(填化学式) 。
⑥取另一张质量与过滤时所使用的相同的滤纸放在另一坩埚(质量为W4g)内干燥与灼烧至恒重W5g。
则该样品中碳酸钙的质量分数为 。
某同学在进行①操作称量样品时,是把样品放在托盘天平的右盘里,左盘里共放了3g砝码,天平摆动到达平衡时,游码处于0.3g的刻度上。这位同学的称量操作对最后结果造成的影响是(填无、偏高、偏低) 。
16、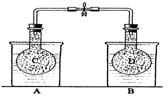 (10分)如下图所示,在25℃时,在烧杯A中装有50.0
mL水,烧杯B中装有0.50
mol/L盐酸50.0 mL,把NO2和N2O4的混和气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放人A烧杯中,D烧瓶放人B烧瓶中。
(10分)如下图所示,在25℃时,在烧杯A中装有50.0
mL水,烧杯B中装有0.50
mol/L盐酸50.0 mL,把NO2和N2O4的混和气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放人A烧杯中,D烧瓶放人B烧瓶中。
往A烧杯中加入50.0 g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0 g NaOH
固体搅拌并使其溶解后。回答下列问题:
(1)烧杯A中温度(填“升高”、“降低”或“不变”)____________;烧杯B中温度(填“升高”、“降低”或“不变”)__________。
(2)已知在NO2生成N2O4的可逆反应里,正反应是放热反应,逆反应是吸热反应:
2NO2(g) 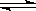 N2O4(g)
N2O4(g)
从上面实验可知C烧瓶内混和气体颜色(填“变浅”、“变深”或“不变”)______;D烧瓶内混和气体颜色(填“变浅”、“变深”或“不变”)_______________。
(3)用pH试纸测定烧杯A中溶液的pH可知其pH(填“大于7”、“等于7”或“小于7”)_________,导致该溶液pH这一变化的原因可用离子方程式表示如下:_______________.
(4)若实验测得B烧杯中酸碱中和反应放热1.4325 kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为___________。
(5)若起始时在D烧瓶中充入m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反
应:N2O4(g) 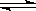 2NO2达到化学平衡状态时压强变为1.515×105Pa,则平衡混和气体
2NO2达到化学平衡状态时压强变为1.515×105Pa,则平衡混和气体
的平均相对分子质量为:__________________。(精确到小数点后两位)
15、(9分)(1)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
(2)下列有关实验的叙述,正确的是(填序号)
A.用渗析法分离淀粉中混有的NaCl杂质
B.用碱式滴定管量取20.00mL高锰酸钾溶液
C.测定某溶液的pH时,将润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色
卡进行对比
D.用浓氨水洗涤做过银镜反应的试管
E.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀
刚好溶解为止
F.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分
G.在氢氧化铁胶体中加少量硫酸会产生沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com