
7.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于难溶物之间转化的说法中错误的是 ( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于×10-11 mol/L
解析:Ksp(AgI)小于Ksp(AgCl),AgI比AgCl更难溶于水,AgCl可以转化为AgI,饱和AgCl溶液中Ag+浓度为×10-5mol/L,根据Qc>Ksp,I-的浓度必须不低于 mol/L.
答案:A
6.已知25℃时,电离常数Ka(HF)=3.6×10-4 mol/L,溶度积常数Ksp(CaF2)=1.46×10-10.现向1 L 0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液,则下列说法中,正确的是 ( )
A.25℃时,0.1 mol/L HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
解析:A项,HF为弱酸,0.1 mol/L HF溶液pH>1;B项,Ksp只与温度有关;C项,混合后成0.1 mol/L HF溶液,设0.1 mol/L的HF溶液中c(F-)=c(H+)=x mol/L,则=3.6×10-4,x≈6×10-3 mol/L,混合后c(Ca2+)=0.1 mol/L,0.1 mol/L×(6×10-3 mol/L)2=3.6×10-6>1.46×10-10,应有CaF2沉淀生成.
答案:D
5.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)  Ca2+(aq)+2OH-(aq).下列说法正确的是
( )
Ca2+(aq)+2OH-(aq).下列说法正确的是
( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
解析:向平衡体系中加入CaO,CaO与H2O反应使c(Ca2+)和c(OH-)都增大,平衡向左移动,由于温度不变,Ksp不变,所以当c(Ca2+)和c(OH-)减小至与原平衡相等时达到新的平衡,c(Ca2+)、c(OH-)未变,pH不变[但n(Ca2+)、n(OH-)减小了,Ca(OH)2的量增大了];给溶液加热,Ca(OH)2的溶解度随温度升高而减小,所以又会有少量Ca(OH)2析出,c(OH-)减小,pH减小;加入Na2CO3溶液,部分Ca(OH)2转化为CaCO3,固体质量增加;加入NaOH(s),平衡左移,Ca(OH)2固体质量增加.
答案:C
4.为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入(已知Fe(OH)3只要在pH>4的环境里就可以沉淀完全) ( )
A.NaOH B.Na2CO3
C.氨水 D.MgO
解析:要除去FeCl3实际上是除去Fe3+,除去Fe3+的方法是使其转化为Fe(OH)3,但直接引入OH-会导致Mg2+也生成沉淀.因此可利用Fe3+易水解生成Fe(OH)3和H+,减小c(H+)使水解平衡向右移动,且不引入杂质离子,选用MgO.
答案:D
3.已知25℃时BaSO4饱和溶液中存在BaSO4(s)Ba2+(aq)+SO(aq),Ksp=1.102
5×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述正确的是 ( )
A.25℃时,向c(SO)=1.05×10-5mol/L的BaSO4溶液中,加入BaSO4固体,c(SO)增大
B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大
C.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO)
D.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO)减小
解析:BaSO4的溶度积等于c(Ba2+)和c(SO)的乘积,故饱和溶液中c(SO)=1.05×10-5mol/L,再加入BaSO4固体不溶解,c(SO)不变,A错误;溶度积常数只与温度有关,B错误;加入Na2SO4固体,溶解平衡向左移动,c(Ba2+)减小,C错误;加入BaCl2固体,溶解平衡向左移动,c(SO)减小,D正确.
答案:D
2.(2009·山东师大附中模拟)将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是 ( )
①20 mL 0.01 mol/L KCl 溶液
②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol/L AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
解析:AgCl(s)  Ag+(aq)+Cl-(aq),由c(Ag+)·c(Cl-)=Ksp,c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解度就越小.①中c(Cl-)=0.01 mol/L
Ag+(aq)+Cl-(aq),由c(Ag+)·c(Cl-)=Ksp,c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解度就越小.①中c(Cl-)=0.01 mol/L
②中c(Cl-)=0.04 mol/L ③中c(Cl-)=0.03 mol/L
④中c(Cl-)=0 ⑤中c(Ag+)=0.05 mol/L.Ag+或Cl-浓度由小到大的顺序为:④<①<③<②<⑤,故AgCl的溶解度由大到小的顺序为:④>①>③>②>⑤.
答案:B
1.下列说法正确的是 ( )
A.硫酸钡放入水中不导电,则硫酸钡是非电解质
B.物质溶于水达到饱和时,溶解过程就停止了
C.绝对不溶解的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
解析:A项,硫酸钡是强电解质,其在水中的溶解度比较小,错误;B项,溶解平衡为动态平衡,错误;D项,残留离子浓度小于10-5mol/L时,则认为该离子沉淀完全,错误.
答案:C
20.(本题满分13分)
已知函数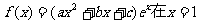 处取得极小值,其图象过点A(0,1),且在点A处切线的斜率为-1。
处取得极小值,其图象过点A(0,1),且在点A处切线的斜率为-1。
(1)求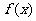 的解析式;
的解析式;
(2)设函数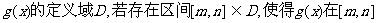 上的值域也是
上的值域也是 ,则称区间
,则称区间 为函数
为函数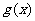 的“保值区间”。
的“保值区间”。
①证明:当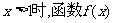 不存在“保值区间”;
不存在“保值区间”;
②函数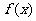 是否存在“保值区间”?若存在,写出一个“保值区间”(不必证明);若不存在,说明理由。
是否存在“保值区间”?若存在,写出一个“保值区间”(不必证明);若不存在,说明理由。
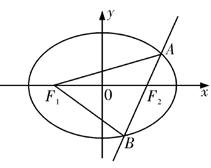
19.(本题满分12分)
已知椭圆C的中心在原点,焦点F1,F2在x轴上,离心率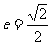 ,且经过点
,且经过点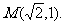
(1)求椭圆C的方程;
(2)若直线l经过椭圆C的右焦点F2,且与椭圆C交于A,B两点,使得|F1A|,|AB|,|BF1|依次成等差数列,求直线l的方程。
18.(本题满分10分)
已知数列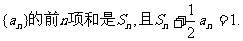
(1)求数列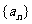 的通项公式;
的通项公式;
(2)设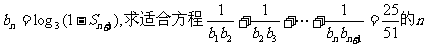 的值。
的值。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com