
14.(14分)某自来水中含有Ca2+、Mg2+、Na+、K+、HCO、SO、Cl-,长期烧煮上述自来水会在锅炉内形成水垢.锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢.已知部分物质20℃时的溶解度数据有:
|
物质 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
CaSO4 |
MgSO4 |
|
溶解度(g/100 g H2O) |
9.0×10-4 |
1.5×10-3 |
1.0×10-2 |
1.7×10-1 |
2.1×10-1 |
26.7 |
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:_____________________________________________________________________.
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去.试剂X是________(填序号).
A.食醋 B.氯化钡
C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)______________________________
__________________________.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)________________.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应.现取含Ca2+浓度为0.40 g/L的自来水样10 mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是____________________.
解析:(1)锅炉水垢中含有Mg(OH)2的原因为
Mg(HCO3)2MgCO3↓+H2O+CO2↑,
MgCO3+H2OMg(OH)2+CO2↑.
(2)水垢中含有的CaSO4不溶于酸,因CaCO3的溶解度小于CaSO4,可先将其转化为易溶于盐酸的CaCO3而除去,所用试剂为碳酸钠.
(3)锅炉水垢中除含有CaSO4、Mg(OH)2之外,还可能含有CaCO3、MgCO3等物质.
(4)该自来水中c(Ca2+)==0.01 mol/L,
所以有10 mL×[0.01 mol/L+c(Mg2+)]=0.01 mol/L×20.00 mL
c(Mg2+)=0.01 mol/L.
答案:(1)Mg(HCO3)2MgCO3↓+H2O+CO2↑,
MgCO3+H2OMg(OH)2+CO2↑
(2)C 碳酸钙的溶解度小于硫酸钙的溶解度
(3)CaCO3、MgCO3等
(4)0.01 mol/L
8.(2)10-17 (3)0<pH<12.0
(4)A、B、C、D
0.50 mol/L HCl为稀盐酸,因有Cl-,抑制了PbCl2电离,故PbCl2在0.5 mol/L HCl中的溶解度小于纯水中的,故B正确.
因随盐酸浓度增大,PbCl2浓度逐渐增大,可知PbCl2与浓盐酸生成了难电离的阴离子,故C正确.
PbCl2能溶于稀盐酸,也能溶于食盐水,D正确.
答案:(1)Zn2++4OH-===[Zn(OH)4]2-
13.(10分)(2009·韶关月考)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.

回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_____________________________________________________________.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
|
c(HCl) |
|
|
|
|
|
|
|
|
(mol/L) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
103 c(PbCl2) |
|
|
|
|
|
|
|
|
(mol/L) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是________.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
解析:(1)向ZnCl2中加入足量NaOH溶液,即OH-过量,由图象知Zn2+与OH-最终生成[Zn(OH)4]2-.
(2)由Zn(OH)2(s) Zn2+(aq)+2OH-(aq)
Zn2+(aq)+2OH-(aq)
知:Ksp[Zn(OH)2]=c(Zn2+)·[c(OH-)]2
将a点数据代入,可得:Ksp=(10-3)·(10-7)2=10-17
(3)由图象可知,当8.0<pH<12.0时,溶液中的Zn2+可与OH-结合为Zn(OH)2沉淀.
(4)由表知,开始PbCl2浓度由5.10降至4.91,又升至5.21,随后逐渐增大,故A正确.
1.(2)减小 (3)0×10-6mol/L
(4)①能 因为Ksp(AgY)=1.0×10-12>Ksp(AgZ)
=8.7×10-17
②能 当溶液中c(X-)>1.8×10-4mol/L时,AgY开始向AgX的转化,若要实现AgY向AgX的完全转化,必须保持溶液中的c(X-)>1.8×10-4mol/L
12.(14分)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡.当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似).
如:AgX(s) Ag++X-
Ag++X-
Ksp(AgX)===c(Ag+)·c(X-)=1.8×10-10
AgY(s) Ag++Y-
Ag++Y-
Ksp(AgY)===c(Ag+)·c(Y-)=1.0×10-12
AgZ(s) Ag++Z-
Ag++Z-
Ksp(AgZ)===c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为________.
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”、“减小”或“不变”).
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________.
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:____________________________________________________________________.
②在上述(3)体系中,能否实现AgY向AgX的转化?根据你的观点选答一项.
若不能,请简述理由:_______________________________________________.
若能,则实验转化的必要条件是:__________________________________________
________________________________________.
解析:(2)由于AgY比AgX更难溶,则向AgY的饱和溶液中加入AgX固体,发生沉淀的转化,AgX(s)+Y-(aq)===AgY(s)+X-(aq),则c(Y-)减小.
(3)25℃时,AgY的Ksp=1.0×10-12,即溶液达到饱和时,c(Ag+)=c(Y-)=1.0×10-6mol/L,而将0.188 g AgY溶于100 mL水中,形成的为饱和溶液(溶质未完全溶解),
则有:c(Y-)=c(Ag+)==1.0×10-6mol/L.
(4)由于Ksp(AgZ)<Ksp(AgY),可以实现AgY向AgZ的转化.在(3)中,c(Ag+)=1.0×10-6mol/L,当c(X-)>1.8×10-4mol/L时,即可由AgY向AgX的转化.
答案:(1)S(AgX)>S(AgY)>S(AgZ)
11.(12分)利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视.
(1)医学上进行钡餐透视时为什么不用BaCO3?(用离子方程式表示)________________________________________________________________.
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:a.5 mL 水;b.40 mL 0.2 mol/L 的Ba(OH)2溶液;c.20 mL 0.5 mol/L的Na2SO4 溶液;d.40 mL 0.1 mol/L 的H2SO4 溶液中,溶解至饱和.
①以上各溶液中,Ba2+的浓度由大到小的顺序为________.
A.b>a>c>d B.b>a>d>c
C.a>d>c>b D.a>b>d>c
②已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液b中的SO浓度为________ mol/L,溶液c中Ba2+的浓度为________ mol/L.
③某同学取同样体积的溶液b和溶液d直接混合,则混合液的pH为________(设混合溶液的体积为混合前两溶液的体积之和).
解析:BaSO4不溶于水也不溶于酸,身体不能吸收,因此服用BaSO4不会中毒.而BaCO3进入人体后,会和胃酸中的盐酸发生反应BaCO3+2H+===Ba2++CO2↑+H2O,Ba是重金属,Ba2+会被人体吸收而导致中毒.
(2)①SO会抑制BaSO4的溶解,所以c(SO)越大,c(Ba2+)越小.②由于c(Ba2+)·c(SO)=1.1×10-10,所以溶液b中c(SO)= mol/L=5.5×10-10 mol/L,溶液c中c(Ba2+)= mol/L=2.2×10-10 mol/L.③溶液b、d混合后发生反应:Ba(OH)2+H2SO4===BaSO4↓+2H2O,由题意知Ba(OH)2过量,溶液中OH-的浓度为×2
=0.1 mol/L,c(H+)==1×10-13 mol/L,pH=13.
答案:(1)BaCO3+2H+===Ba2++CO2↑+H2O
(2)①B ②5.5×10-10 2.2×10-10 ③13
10.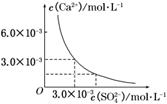 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如右图
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如右图
所示,向100 mL该条件下的CaSO4饱和溶液中,加入400
mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正
确的是 ( )
A.溶液中析出CaSO4沉淀,最终溶液中c(SO)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO)较原来大
解析:由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)=c(SO)=3.0×10-3mol/L,Ksp(CaSO4)=9.0×10-6.当向100 mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液后,混合液中c(Ca2+)=6.0×10-4 mol/L,c(SO)=8.6×10-3mol/L,溶液中c(Ca2+)·c(SO)=5.16×10-6<Ksp(CaSO4)=9.0×10-6,所以混合液中无沉淀析出.
答案:D
9.要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
|
化合物 |
PbSO4 |
PbSO3 |
PbS |
|
溶解度/g |
1.03×10-4 |
1.81×10-7 |
1.84×10-14 |
由上述数据可知,选用的沉淀剂最好是 ( )
A.硫化物 B.硫酸盐
C.碳酸盐 D.以上沉淀剂均可
解析:从PbSO4、PbCO3、PbS的溶解度上看,PbS溶解度最小,故最好选用硫化物.
答案:A
8.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO+H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO===CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是 ( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
解析:根据沉淀转化一般规律:溶解度小的沉淀易转化为溶解度更小的沉淀,故由反应(1)知,溶解度CuCO3>Cu(OH)2,由反应(2)知Cu(OH)2>CuS.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com