
16、(1)Mg2++2OH-== Mg(OH)2 ↓
(2)Ca2++CO32-==CaCO3↓
第4课时 (B卷)
纠错训练
15、(1)2 (2) 0.64mol
14、(1)SO32-、S2-、CO32- (2) SO42-
(3)SO42-、SO32-、CO32-
(4)SO42-、SO32-、Cl-三种中至少有一种
8、BD 9、D 10、AC 11、A 12、B 13、D
1、 AC 2、D 3、AD 4、B 5、AC 6、B 7、D
5、一组是H+、Al3+、NO3-、MnO4-、Fe3+、NH4+ 另一组是OH-、Na+、K+、AlO2-、CO32-、S2-
新活题网站
4、(1)2H+ + SO42-+ Ba2++ 2OH- = 2H2O + BaSO4↓
(2)Ba2+ + SO42- = BaSO4↓
1、BD 2、B 3、A
14.我国中医药已有数千年历史,其独特的疗效使得经深加工的中药产品正逐步进入国际市场,但国外在进口中药时对中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素砷的检验方法和步骤(As在中草药中主要以As2O3的形式存在):①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;②将待测溶液转移入250mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液;③用标准碘溶液滴定待测溶液至终点,消耗20.25mL标准I2溶液,其中发生反应:
H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)。
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
(2)配平离子反应方程式:____H3AsO3+____I2+____H2O- ____H3AsO4+____I-+____H+
(3)0.2%的淀粉溶液的作用是 ,如何判断滴定到达终点?____________________________。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程 。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为 mg/kg,故该草药样品 (填“合格”或“不合格”)。
13. 2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,
该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)
ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)
ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
(3)①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:
。
②合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C 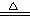 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为 g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com