
(2008·江苏高考)下图为江苏省三大产业产值比重与城市人口比重的变化图。读图回答6-7题。
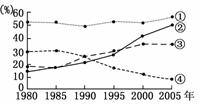
6.图中曲线标注的序号与文字说明对应正确的是 ( )
A.①--城市人口比重
B.②--第三产业产值比重
C.③--第二产业产值比重
D.④--第一产业产值比重
解析:江苏省位于我国东部沿海地区,经济发展水平较高,其三大产业比重大小依次为二、三、一,且第一产业比重下降,第三产业比重增加;改革开放以来其城市化发展速度较快,2005年达到50%左右。综上分析可知,①代表第二产业产值比重,②代表城市人口比重,③代表第三产业产值比重,④代表第一产业产值比重。
答案:D
7.图示曲线反映了 ( )
A.第二产业产值比重增长的速度最快
B.20世纪80年代末城市化速度最快
C.1990年以后第三产业产值比重超过第一产业
D.城市人口增长与第二产业发展同步
解析:根据上题的结论,可判断出1990年以后第三产业产值比重超过第一产业,第三产业产值比重增长的速度最快,20世纪90年代末城市化速度最快,城市人口增长落后于第二产业的发展。
答案:C
23.(10分)Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20 mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20 mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 。
(2)根据上表数据分析,该样品 (填选项字母)
A.只含有Na2S2O3
B.含有Na2S2O3和Na2SO3两种成分
C.含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比。
(4)求所加硫酸溶液的物质的量浓度是多少?
(5)若将63g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位) 。
试讨论:当a在不同取值范围时,SO2的体积b。并请在图上画出b随a变化的曲线。
22.(8分)在标准状况下,将质量为相同状况下同体积氢气质量16倍的CO2和CO的混合气体,充入盛有足量Na2O2且容积为2.24 L的密闭容器中(固体的体积忽略不计),用间断发生的电火花引发反应,使可能发生的反应充分进行。试计算:
(1)反应前充入容器中的CO2和CO的物质的量各是多少?
(2)最后容器中的生成物有哪些?其质量各是多少?
21.(8分)有机物X由C、H、O三种元素组成,X的沸点是198℃,已知:①在一定温度和压强下,在密闭容器中把4.2LX蒸气和16.0LO2混合点燃,当充分反应后,将温度和压强恢复到原来状况,得混合气体A为26.5L(已知在该实验状况下气体的摩尔体积为42.0L/mol);②当A处于标准状况下时,气体体积变为7.3L,此时测得气体对H2的相对密度为19.64。解答下列问题:
(1)推断气体A的组成(简述过程和结论)。
(2)计算A的各组分的物质的量。
(3)确定X的分子式和结构简式。
20.(10分)工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3-4时,Fe3+以Fe(OH)3的形式完全沉淀。
⑴为除去溶液中Fe2+,可采用的方法是 。
⑵工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为_____________________________________________________。溶液的pH变化是 。
⑶若此溶液只含Fe3+时,要调整pH在3-4之间,此时最好向溶液中加入 。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
19.(10分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
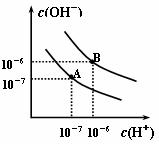 (1)则25℃时水的电离平衡曲线应为 ,(填“A”或 “B”),请说明理由____________。
(1)则25℃时水的电离平衡曲线应为 ,(填“A”或 “B”),请说明理由____________。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2 =b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH 1与强碱的pH 2之间应满足的关系是_____。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:_____________________________________。
18.(8分)工业上生产盐酸,必须先合成氯化氢气体,生产中得到的氯化氢气体中或多或少都会含有生成氯化氢的一种反应物,将该混合物用蒸水吸收可得一定浓度的纯盐酸,此过程中逸出的气体可以循环利用。
(1)写出工业电解食盐水制取H2和Cl2的化学方程式:_________________________。
(2)工业上要得到纯盐酸并保障工人工作安全,如何合成氯化氢是关键的一步。则下列合成氯化氢气体的方法能达到生产目的的是________。
A.点燃H2和Cl2的混合物,二者体积(标准状况下测定)比为1∶1最合适
B.点燃H2和Cl2的混合物,二者体积(同温同压下测定)比不应为1∶1
C.纯净的H2在过量的Cl2中安静地燃烧
D.纯净的Cl2在过量的H2中安静地燃烧
(3)工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。
①残液中氯化钠的质量分数(用含a、b、c的代数式表示)为__________________。
②残液中NaOH的物质的量浓度(用含a、b、c、ρ的代数式表示)为___________。
17. (6分) (1)用惰性电极电解一定浓度的400mL硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,向所得的溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________mol。
(2)如果向所得的溶液中加入0.1molCu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________mol。
(3)如果向所得的溶液中加入0.1molCu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为________mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com