
1.(江苏省射阳中学2009届高三第二次月考) (10分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
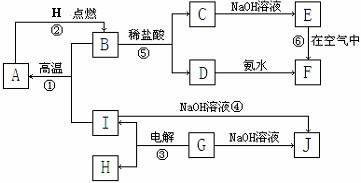
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素的原子结构示意图为_________;
(2)若C→D为化合反应,则此时的化学方程式________ ___;
(3)写出反应④的离子方程式_____________ _;
(4)写出反应③的电极方程式:阳极:______________ 阴极:____________
(5)从能量变化的角度看,①②③反应中属于△H>0的反应是_______。(填序号)
答案:
(1) (2分)
(2)8Al+3Fe3O4 4Al2O3+9Fe (2分)
4Al2O3+9Fe (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)③ (2分)
⒈同分异构现象与同分异构体
⑴定义:
⑵存在:①无机物与无机物
②无机物与有机物
③有机物与有机物
⑶判断:分子式相同,结构不同
⒉“五同”的比较:
同位素
同素异形体
同系物
同分异构体
同一物质(CH2Cl2、H4SiO4)
⒊同分异构体的类别:
⑴C链异构:
同种物质间由于主链碳原子数不同引起的异构现象。如正戊烷、异戊烷、新戊烷。
⑵官能团位置异构:
由于官能团在分子中的位置不同引起的异构现象。如是1-丙醇和 2-丙醇,邻二甲苯、间二甲苯和对二甲苯等。
⑶官能团种类异构:
常见的官能团异构有:
①烯烃和环烷烃:通式为
②二烯烃和炔烃:通式为
③饱和一元醇和醚:通式为
④饱和一元醛、酮和烯醇:通式为
⑤饱和一元羧酸、酯和羟基醛:通式为
⑥芳香醇、芳香醚和酚:通式为
⑦硝基化合物和氨基酸:通式为
⑧葡萄糖和果糖:分子式为
⑨蔗糖和麦芽糖:分子式为 。
⒋同分异构体的书写:
顺序:先写C链异构,再写官能团位置异构,最后考虑其它官能团种类异构。
⑴烷烃:n<7的烷烃
⑵烯烃:C4H8
⑶烃的含氧衍生物:C5H12O
⒌其它异构:烯烃的顺反异构、烷烃的手性异构
试题枚举
[例1] ⑴由2个C原子、1个O原子、1个N原子和若干个H原子组成的共价化合物,H的原子数目最多为 个,试写出其中一例的结构简式 。
⑵若某共价化合物分子只含有C、N、H三种元素,且以n(C)和n(N)分别表示C和N的原子数目,则H原子数目最多等于 。
⑶若某共价化合物分子中只含有C、N、O、H四种元素,且以n(C),n(N)和n(O)分别
表示C、N和O的原子数目,则H原子数目最多等于 。
答案:⑴7,HO-CH2-CH2-NH2 ⑵2n(C)+n(N)+2 ⑶2n(C)+n(N)+2
[例2]下列物质中,一定是同系物的是( )
A.C2H4和C4H8 B.CH3Cl和CH2Cl2
C.C4H10和C7H16 D.硬脂酸和油酸
 解析:A.两种物质虽然符合通式CnH2n,但C4H8可能单烯烃也可能为环烷烃,环烷烃和C2H4不可能为同系物.B.虽然均为CH4的氯代物,但卤素原子不同,且C数相同,故不是同系物
C.均属烷烃,应为同系物 D.硬脂酸(C17H35COOH)、油酸(C17H33COOH)均含有-COOH,但油酸还含 C=C 。官能团种类不同,不为同系物。
解析:A.两种物质虽然符合通式CnH2n,但C4H8可能单烯烃也可能为环烷烃,环烷烃和C2H4不可能为同系物.B.虽然均为CH4的氯代物,但卤素原子不同,且C数相同,故不是同系物
C.均属烷烃,应为同系物 D.硬脂酸(C17H35COOH)、油酸(C17H33COOH)均含有-COOH,但油酸还含 C=C 。官能团种类不同,不为同系物。
答案:C.
[例3]羟酸A(分子式为C5H10O2)可由醇B氧化而得,A与B可生成酯,符合此条件的酯可能有几种? O
解析:C5H10O2的羧酸组成C4H9C-OH,其中C4H9-的同分异构体有4种:
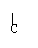
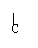
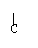 C-C-C-C-, C-C-C- , C-C-C-, C-C-,
C-C-C-C-, C-C-C- , C-C-C-, C-C-,
醇B必须具有A的烃基结构,且-CH2OH在链端,故与A形成的酯也只有4种。
答案:4
[例4]为金刚烷的空间结构(碳架)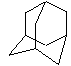
它的一氯代物、二氯代物各有几种?
解析: 为说明清楚,先对碳编号.
从图中可看出,分子内由C原子构成的
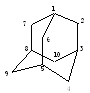 最小的环为6元环,这样的环共有4个,且
最小的环为6元环,这样的环共有4个,且
4个环完全等同,整个分子结构中,1,3,5,
8号位碳等同,每个C上有1个H,2,6,7, 4,10,9号位C等同,每个C上有2个H.
|
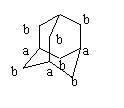 如何寻找二氯代物有几种?
如何寻找二氯代物有几种?
对两种不同位置的H分类为a、b
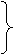 a-a
1种
a-a
1种
a-b 2种 6种
b-b 3种 (注意:b位上有2个H)
答案:2 、6
3.常见有机物的组成、结构、杂化形式、空间构型:
|
|
分子式 |
结构简式 |
空间构形 |
杂化形式 |
化学键 |
|
⑴甲烷 |
|
|
|
|
|
|
⑵乙烯 |
|
|
|
|
|
|
⑶乙炔 |
|
|
|
|
|
|
⑷苯 |
|
|
|
|
|
⒈有机物中C原子的成键特点:
⑴每个C不但可与其它原子形成 个共价键,而且C与C间也可成共价键;
⑵C原子间不仅可以形成C-C,还可以形成 与 ;
⑶多个C原子间可以形成长短不一的C链,C链中带有支链;还可以结合成C环,
且C链与C环也可结合;
⑷原子种类、数目相同的分子,原子间有多种结合方式,可出现不同结构的分子,即存在
同分异构体。
有机物种类繁多主要是由 和 决定的。
2.有机物的组成与结构的表示方法:
⑴表示有机物组成的化学式:分子式、最简式(实验式)
⑵表示有机物结构的化学式:
电子式、结构式、结构简式(示性式)、键线式(骨架式)
结构简式:结构式的简写形式,省略部分或全部C-C、C-H后的式子,双、三键不省。
键线式:省略CH元素符号,用“-”表示碳碳键,每个拐点或终点均表示一个C原子,
其它元素符合和化学键不省的式子。
⑶表示有机物结构的模型:球棍模型、比例模型
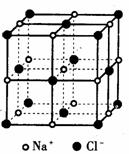
24. (本大题12分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则:
(1)第二层离子有 _____________个,离中心离子的距离为_____________,它们是_____________离子。
(2)已知在晶体中Na+离子的半径为116p m,C1-离子的半径为167p m,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。
23. (本大题16分)随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m g NaCl固体并转移到定容仪器A中 ②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V mL回答下列问题:
(本大题16分)随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m g NaCl固体并转移到定容仪器A中 ②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V mL回答下列问题:
(1)步骤①中A仪器最好用 _____________(填仪器名称)
(2)能否用胶头滴管代替步骤②中的滴定管?其原因是__________________________
(3)能否用水代替苯_____________理由是__________________________
(4)已知NaCl晶胞的结构如图所示,经X射线衍射测得晶胞中最邻近的Na+和C1-平均距离为acm,则利用上述方法测得的阿伏加德罗常数的表达式为NA=_____________。
(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为_____________。
22.(本大题6分)金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,求
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2)金的密度为_________g·cm-3。 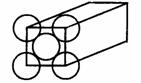
21.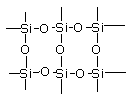 (本大题6分)(1)石英晶体的平面示意图如下图所示,实际上是立体网状结构,其中硅氧原子个数比为_______________________
(本大题6分)(1)石英晶体的平面示意图如下图所示,实际上是立体网状结构,其中硅氧原子个数比为_______________________
(2)SiO44-离子结构可用图表示 ,在聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是_____________
,在聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是_____________
20.科学家最近又发现了一种新能源--“可燃冰”它的主要成分是甲烷与水分子的结晶水合物(CH4·nH20)。其形成:埋于海底地层深处的大量有机质在缺氧环境中,厌氧性细菌把有机质分解,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。又知甲烷同C02一样也是温室气体。这种可燃冰的晶体类型是( )
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
19.氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是( )
A.硝酸钠和金刚石 B.晶体硅和水晶 C.冰和干冰 D.苯和酒精
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com