
7. (09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
 A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
 B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
 D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
答案:C
解析:A中镁为0.1mol,失去的电子数为0.2 NA;B中盐酸无体积,不能计算出粒子数;D选项中使用气体摩尔体积不是在标准状况下
6.(09年山东理综·10)下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若35 17Cl、37 17若Cl为不同的核素,有不同的化学性质 学科
学科
C.实验室制备Cl2,可用排放和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
答案:C
 解析:本题以氯元素为载体,从氧化还原、原子结构、收集方法不同角度进行考查,体现了山东理综化学选择题的命题模式。氯气与水的反应既是氧化剂也是还原剂;同一元素的不同核素化学性质几乎完全相同而物理性质不同;D中提Cl2的体积未指明是标准状况。实验室制备Cl2,可用排饱和食盐水集气法收集也可用瓶口向上排空气法收集,故C正确。
解析:本题以氯元素为载体,从氧化还原、原子结构、收集方法不同角度进行考查,体现了山东理综化学选择题的命题模式。氯气与水的反应既是氧化剂也是还原剂;同一元素的不同核素化学性质几乎完全相同而物理性质不同;D中提Cl2的体积未指明是标准状况。实验室制备Cl2,可用排饱和食盐水集气法收集也可用瓶口向上排空气法收集,故C正确。
5.(08年山东理综·13)NA代表阿伏伽德罗常数,下列叙述错误的是A
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1NH4Cl溶液与2 L0.25mol·L-1NH4Cl溶液含NH4+物质的量不同
 答案:A
答案:A
解析:选项A中根据稀释前后溶质的质量不变得:10mL×ρ(前)×98%=100mL×ρ(后)×ω(后),所以ω(后)=,由于反应前后溶液的密度不能确定,所以其质量分数也不能确定;选项B中n(O2)=1mol,O元素的化合价从-1价变为0价,所以每个O原子失去1个电子,故反应中转移的电子数为2NA;选项C中分子数为NA的CO和C2H4其物质的量为1mol,则在标准状况下所占的体积为22.4L,由于它们的摩尔质量都是28g·mol-1,即平均摩尔质量也为28g·mol-1,所以其质量为28g;选项D中由于NH4++H2O NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
4.(08年江苏化学·3)用NA表示阿伏加德罗常数的值。下列叙述正确的是C
A.常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
B.标准状况下,22.4 L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1 L浓度为1 mol·L-1的Na2CO3溶液中含有NA个CO32-
答案:C
解析:选项A中n(Al)=1mol,Cl2的物质的量不能确定,当Cl2的物质的量小于1.5mol时,转移的电子数小于3NA,当Cl2的物质的量等于或大于1.5mol时,转移的电子数为1.5mol;己烷在标准状况下为液体,所以其物质的量不能用n=来确定;选项C中含有NA个分子的CO2和O2,其物质的量为1mol,而不管是CO2还是O2
1mol中均含有2mol的O,NA个CO2和O2的混合气体所含的O数为1mol;选项D中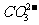 为弱酸根离子,水解后使得
为弱酸根离子,水解后使得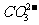 -的物质的量小于1mol,
-的物质的量小于1mol,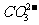 的个数小于NA。
的个数小于NA。
3. (08年广东化学·10)设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
答案:BC
 解析:Fe过量可使Fe3+还原为Fe2+,A错误。3NO2+H2O==2HNO3+NO,易知B正确。C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果
解析:Fe过量可使Fe3+还原为Fe2+,A错误。3NO2+H2O==2HNO3+NO,易知B正确。C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果 3Fe+4H2O===Fe3O4+4H2↑,由方程可知D错误。
3Fe+4H2O===Fe3O4+4H2↑,由方程可知D错误。
2. (08年广东化学·6)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是A
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
答案:A
解析:m(Al):m(NaOH)=27:40;
m(Al(OH)3):m(NaOH)=75:40;
m(AlCl3):m(NaOH)=33.375:40;
m(Al2O3):m(NaOH)=51:40;
所以相同质量的物质,消耗碱量最多的是Al。故选A。
1. (07年宁夏理综·10)若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7︰4
答案:C
解析:Cl2作为氧化剂时化合价有0价降低为-1价,而Cl2是双原子分子,因此1 mol
Cl2作为氧化剂得到的电子数应为2NA,故A选项错误;在标准状况(0℃、101kPa)时,22.4L氢气的物质的量的1mol,其中含有的H原子的物质的量为2mol,即含有2NA个氢原子,故B选项错误;14g氮气中含有的电子的物质的量为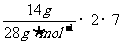 =7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5
mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
=7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5
mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
2.与相对密度D:A气体与B气体密度的比值称为A对B的相对密度 D=

击破考点一:基本概念
例1:如果我们规定12C的相对原子质量为24,且0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),那么下列几种物理量会有变化吗?若有,请说明变化结果。
(1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量
(4)O2的相对分子质量 (5)气体摩尔体积
(6)98%(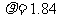 )硫酸的物质的量浓度
(7)44gCO2所含的分子个数
)硫酸的物质的量浓度
(7)44gCO2所含的分子个数
答案:(1)不变(2)变为原来的2倍(3)变为原来的2倍(4)变为原来的2倍(5)变为原来的2倍 (6)变为原来的0.5倍(7)不变
解析:(1)在规定12C的相对原子质量为24时,实际上是把作为相对原子质量的标准从原来用12C质量的1/12,改为1/24,但是单个碳原子的质量并没有因此而发生改变;
(2)原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),很明显0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍;故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023);
(3)原来所称摩尔质量,实质上是指1摩尔物质的质量即6.02×1023个微粒集体的质量,当作出了上述规定后,1摩尔所含的粒子数已经变成了原来的2倍,故其质量也就为原来的2倍;
(4) 原来氧分子的相对分子质量=氧分子的质量/12C质量的1/12,现在氧分子的相对分子质量=氧分子的质量/12C质量的1/24,即作为相对原子质量的标准变为了原来的一半,而氧分子的质量是固定的,故氧分子的相对分子质量变为原来的2倍;
 (5)气体摩尔体积是指在一定的温度和压强下, 阿伏加德罗常数个气体分子所占有的体积,由于阿伏加德罗常数已经变成了原来的2倍,气体摩尔体积当然也就是原来的2倍了;
(5)气体摩尔体积是指在一定的温度和压强下, 阿伏加德罗常数个气体分子所占有的体积,由于阿伏加德罗常数已经变成了原来的2倍,气体摩尔体积当然也就是原来的2倍了;
(6) 溶质的物质的量浓度(CB)=溶质的物质的量(n)/溶液的体积(V),在单位体积的98%(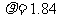 )硫酸中所含溶质--硫酸的质量是不变的
)硫酸中所含溶质--硫酸的质量是不变的
(7) 不论作为相对原子质量的标准如何变化,单个CO2分子的质量并未变化,故一定质量的CO2所含的分子个数是不会发生变化的。
[变式训练1]下列说法中,正确的是 ( )
A.KOH的摩尔质量是56g
B.一个碳原子的质量就是其相对原子质量
C.硫原子的质量就是硫的相对原子质量
D.氦气的摩尔质量在数值上等于它的相对原子质量
答案:D
解析:摩尔质量的单位应当是g/mol,而不是g,故A不对;碳原子的相对原子质量是指拿一个碳原子质量除以一个12C原子质量的1/12所得的比值;硫原子的质量除以一个12C原子质量的1/12所得的比值才是硫的相对原子质量,所以B、C均不对。
[变式训练2]下列叙述中,正确的是 ( )
A.二氧化硫的摩尔质量是64g B.镁的原子质量就是镁的相对原子质量
C.水的相对分子质量等于18g D.一个16O的实际质量约等于16/6.02×1023g
答案:D
击破考点二: 阿伏加德罗常数(NA)的含义与应用
例2:若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7︰4
答案:C
解析:Cl2作为氧化剂时化合价有0价降低为-1价,而Cl2是双原子分子,因此1 mol
Cl2作为氧化剂得到的电子数应为2NA,故A选项错误;在标准状况(0℃、101kPa)时,22.4L氢气的物质的量的1mol,其中含有的H原子的物质的量为2mol,即含有2NA个氢原子,故B选项错误;14g氮气中含有的电子的物质的量为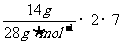 =7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5
mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
=7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5
mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
 [变式训练3](浙江09届海宁市高三9月模拟)设NA代表阿伏加德罗常数,下列说法正确的是
( )
[变式训练3](浙江09届海宁市高三9月模拟)设NA代表阿伏加德罗常数,下列说法正确的是
( )
A.100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子数均为0.2NA
B.20 g重水(D2O)中含有的电子数为10NA
C.在标准状况下,22.4LC8H18完全燃烧,生成CO2的分子数为8NA
D.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
答案:B
[变式训练4](2009届广东省中山一中高三第二次统测) NA代表阿伏加德罗常数,下列叙述错误的是 ( )
A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+ 物质的量不同
答案:A
[变式训练5](广西省柳州市2009届高三10月模拟考)以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
B.1mol 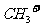 (碳正离子)中含有电子数为10NA
(碳正离子)中含有电子数为10NA
C.标准状况下,22.4LCCl4所含的原子数为5NA
D.60gSiO2中含Si-O键的个数为4 NA
答案:D
击破考点三:能运用物质的量进行有关计算
例3:把6mol铜投入含8mol硝酸和2mol硫酸稀溶液中,则标准状况下放出的气体的物质的量为 ( )
A.2mol B.3mol C.4mol D.5mol
答案:B
解析:该题利用稀硝酸的性质,设下了 “陷阱”,很多同学只考虑铜与稀硝酸反应而不与稀硫酸反应;根据方程式判断铜过量,计算得到NO的物质的量为2mol。从而掉入命题人设计的陷阱。
事实上铜与稀硝酸反应生成的硝酸铜中还有硝酸根离子,同样在硫酸中具有氧化性,仍可和过量的铜粉发生反应。该题最好写成离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.根据此方程式进行计算。
[变式训练6]在某100ml的混合液中,硝酸和硫酸的物质的量浓度分别为0.4mol.L-1和0.1 mol.L-1,向该混合溶液中加入1.92克铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol.L-1 )是 ( )
 A.0.15
B.0.225
.C.0.35
D.0.45
A.0.15
B.0.225
.C.0.35
D.0.45
答案:B
[变式训练7]ag铁粉与含有H2SO4 的CuSO4 溶液完全反应后,得到ag铜,则参与反应的CuSO4和H2SO4的物质的量之比为( )
A.1:7 B.7:1 C.7:8 D8:7
答案:B
解析:根据题意可以知道,铁粉完全反应且反应前后固体的质量不变,因此设参加反应的CuSO4与H2SO4的物质的量分别为x和y,则:
Fe + CuSO4 = FeSO4+Cu △m
1mol 56g
x 56 x g·mol-1
Fe + H2SO4 = FeSO4+H2↑ △m
1mol 8g
y 8 y g·mol-1
因反应前后固体的质量没有发生变化,因此第一个反应质量的减小等于第二个反应质量的增加,即56x g·mol-1=8 y g·mol-1,所以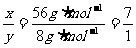 。
。
击破考点四:有关气体摩尔体积的概念和计算
例4:下列有关气体体积的叙述中,正确的是( )
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由物质的量多少决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
答案:B
解析:气体体积是由气体分子数目多少及气体分子间平均距离决定的,与气体分子本身的大小无关,而气体分子间的平均距离又是由外界因素中的温度与压强决定的;故A错而B对;相同分子数目的气体若外界温度、压强不同,其体积就可以不同,C错;气体摩尔体积是指一定温度、压强下单位物质的量的气体所占的体积,但其数值不一定为22.4升,D错。
变式训练8:下列有关气体叙述中,正确的是( )
A.在标准状况下,1molSO3的体积约为22.4L
B.在一定的温度和压强下,各种气体摩尔体积相等
C.同种气体的摩尔体积总是相同的
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
答案:B
击破考点五:阿伏加德罗定律及其推论的应用
 例5:(08年海南化学·3)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是B
例5:(08年海南化学·3)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是B
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
答案:B
解析:根据阿伏加德罗定律可知同温同压下气体的密度之比等于摩尔质量之比,即=,由于>1,所以M(甲)>M(乙);由于它们的质量相等,所以甲的物质的量比乙的物质的量少,甲的分子数比乙少;由于它们的外界条件相同,所以它们的摩尔体积相同。
[变式训练9](江苏省口岸中学2009届高三年级第二次月考化学试题)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的相对分子质量比乙的相对分子质量小
B. 甲的摩尔体积比乙的摩尔体积小
C.甲的分子数比乙的分子数少
D.甲中所含的原子数比乙中的所含的原子数少
答案:C
[变式训练10]标准状况下,mg气体A与ng气体B所含分子数相同,下列说法不正确的是
A. A与B相对分子质量之比为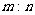
B. 同质量的A与B所含分子数之比为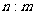
C. 相同状况下,同体积的A与B的质量之比为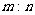
D. 标准状况下,A与B的密度之比为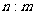
答案:D
击破考点六:有关物质的量浓度的计算
例6:有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl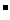 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
答案:D
考点:本题考查了物质的量浓度的相关计算。
解析:本题的解题关键是将溶液分成两份,即每份体积为a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(Cl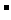 )=n(AgNO3)=ymol,根据电荷守恒 2x[Ba2+]+[Na+]=[Cl
)=n(AgNO3)=ymol,根据电荷守恒 2x[Ba2+]+[Na+]=[Cl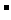 ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl )。n( Na+)=y-2xmol,所以c(Na+)为(y-2x)/2a即(2y-4x)/a 。
)。n( Na+)=y-2xmol,所以c(Na+)为(y-2x)/2a即(2y-4x)/a 。
 [变式训练11]等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1。则a与b的关系为
[变式训练11]等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1。则a与b的关系为
A.a=b B.a=2b C.2a=b D.a=5b
答案:C
[变式训练12](四川省双流县棠湖中学09届高三第二次月考)将500gCuSO4·5H2O溶解于水得到2L溶液,下列说法正确的是
A.CuSO4的浓度是2 mol/L
B.Cu2+的浓度是1mol/L
 C.SO42―的浓度是1mol/L
C.SO42―的浓度是1mol/L
D.将所得溶液蒸发得到的晶体是硫酸铜固体
答案:C
击破考点七:有关物质的量浓度与溶解度、质量分数的换算
例7:某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%.300ml该溶液中Cl-的物质的量约等于( )
A. 0.37mol B. 0.63mol C. 0.74mol D. 1.5mol
答案:D
[变式训练13]14.2 g质量分数为69%的浓硝酸(密度为1.420 g·cm-3)与10 mL 15.55 mol·L-1的硝酸的浓度相比
A.是同一浓度的不同表示方法 B.数值不同,但也能换算为相同值
C.是不同浓度的两种硝酸 D.无法比较其大小
答案AB
解析: c(HNO3)=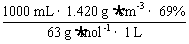 =15.55
mol·L-1:
=15.55
mol·L-1:
[变式训练14]有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A.溶质的质量分数是24.0% B.溶液的物质的量浓度是2.4 mol/L
C.溶质和溶剂的物质的量之比是1∶40 D.硫酸根离子的质量分数是19.2%
答案:C
击破考点八: 有关气体溶质溶液的物质的量浓度的计算
例8:将标况下a LHCl(g)溶于1000克水中,得到密度为b g·cm-3的溶液,则该盐酸的物质的量浓度(mol·L-1)是 ( )
 A.
A.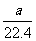 B.
B.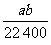
C.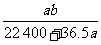 D.
D.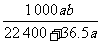
答案:D
[变式训练15]将标准状况下VL HCl气体溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为
A. V/22400mol/L B.1000V/22.4mol/L
C.V/22.4mol/L D.V/11.2mol/L
答案:C
[变式训练16]在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g/cm3,取此盐酸10.0mL,稀释至1.45L,则稀释后所得稀盐酸的物质的量浓度为多少?
答案:0.08 mol/L
击破考点九: 一定物质的量浓度溶液的配制及误差分析
例:(江苏海门市2008-2009学年高三第一次教学质量调研)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________
A.实验中所用到的滴定管.容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
答案: A、B、D
[变式训练17]在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。
(3)配制氯化钠溶液时,容量瓶中有少量水。______________。
(4)定容时,液面上方与刻度相齐时,停止加水。__________。
(5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。
 (6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线____________。
(6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线____________。
答案:(1)偏低 (2)偏低 (3)无影响 (4)偏高 (5)无影响 (6)偏低
[变式训练18]实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取的Na2CO3质量分别为( )
A.1000mL , 212g B.950mL , 201.4g C.500mL , 286g D.1000mL , 201.4g
解析:由于容量瓶的规格中不可能有950mL,只能选择略大于所需溶液体积的规格(即1000mL),计算溶质的质量时也就按1000mL溶液中所含的溶质。
答案:A
击破考点十: 有关物质的量及物质的量浓度的综合计算题
例10:一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O, 所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
答案:B
解析:据题意并结合提示,H2C2O4为二元弱酸,可写出氢氧化钠与KHC2O4.H2C2O4.2H2O反应的方程式:6NaOH+2KHC2O4.H2C2O4.2H2O=3Na2C2O4+K2C2O4+8H2O;
10[KHC2O4.H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2+32H2O 。
设需要KMnO4溶液体积为V L,则需要NaOH为3V L,由以上两个方程式可得关系式
10KHC2O4·H2C2O4--8KMnO4--30NaOH
8 30
CV 0.3000V 解得C=0.08000mol/L
[变式训练19](2009届广东省中山一中高三第二次统测)某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
|
|
50 mL盐酸 |
50 mL盐酸 |
50 mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据不能计算混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
答案:BD

1.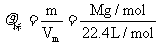 气体的密度ρ:
气体的密度ρ:
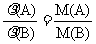
2.阿伏加德罗定律的相关推论
①同温同压下气体体积比等于其 物质的量比
②同温同压下气体的密度比等于其 摩尔质量比
③同温同体积时,气体的压强比等于其物质的量比,等于 体积比
必须指出的是:无论是阿伏加德罗定律还是它的推论,均只适用于气体物质。
 V气体(标准状态)(L)
V气体(标准状态)(L)


 粒子数(N)
物质的量(n)
物质的质量(g)
粒子数(N)
物质的量(n)
物质的质量(g)
V溶液(L)
请你将上述关系图的转化方法标出来。w.w.w.k.s.5.u
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com