
9.在298 K,101 kPa时,1 mol物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.一些烷烃的燃烧热如下表:
|
化合物 |
燃烧热(kJ/mol) |
化合物 |
燃烧热(kJ/mol) |
|
甲烷 |
891.0 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
异戊烷 |
3531.3 |
下列表达正确的是 ( )
A.正戊烷的燃烧热大于3531.3 kJ/mol
B.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
C.正丁烷转化为异丁烷的热化学方程式为:
CH3CH2CH2CH3(g)===CH3CH(CH3)CH3(g)ΔH=+8.4 kJ/mol
D.甲烷燃烧的热化学方程式为:
CH4(g)+2O2(g)===CO2(g)+2H2O(g)
Δ H=-891.0 kJ/mol
解析:根据正丁烷、异丁烷燃烧热的关系推测A是正确的;相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,B错误;正丁烷转化为异丁烷的反应应该是放热反应,C错误;甲烷燃烧热应该是生成液态水放出的热量,D错误.
答案:A
8.美国新任总统奥巴马就环境问题公开表示,到2020年,美国将会把温室气体排放量削减到1990年水平的80%,此外美国将把新能源比重提高到30%.奥巴马还计划每年拿出150亿美元大举投资太阳能、风能和生物能源等,并且举全国之力构建美国的低碳经济领袖地位.下列说法不正确的是 ( )
A.CO2、甲烷都属于温室气体
B.用甘蔗生产的乙醇燃料属于可再生性能源,利用乙醇燃料不会产生温室气体
C.太阳能、风能和生物能源属于新能源
D.太阳能电池可将太阳能直接转化为电能
解析:乙醇燃烧会产生温室气体CO2.
答案:B
7.化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是( )
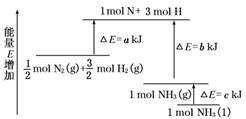
A.N2(g)+3H2(g)===2NH3(l)ΔH=2(a-b-c) kJ/mol
B.N2(g)+3H2(g)===2NH3(g)ΔH=2(b-a) kJ/mol
C.N2(g)+H2(g)===NH3(l) ΔH=(b+c-a) kJ/mol
D.N2(g)+H2(g)===NH3(g)ΔH=(a+b) kJ/mol
解析:由能量图象知, mol N2(g)和 mol H2(g)需要吸收a kJ的热量分解为1 mol N和3 mol H,而1 mol N和3 mol H放出b kJ的热量生成1 mol NH3(g),1 mol NH3(g)液化放出c kJ热量,因此由 mol N2(g)和 mol H2 (g)生成1 mol NH3(l)的反应热为(a-b-c) kJ.
答案:A
6.(2009·合肥模拟)盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
已知:①H2O(g)===H2O(l) ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l) ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(kJ) ( )
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3
解析:设计以下变化过程:
C2H5OH(g)-Q32CO2(g)+3H2O(g)
↑Q2 ↓-3Q1
C2H5OH(l), 2CO2(g)+3H2O(l)
根据盖斯定律ΔH=(-Q3+Q2-3Q1) kJ/mol,故有23 g液态酒精(0.5 mol)完全燃烧生成CO2和液态水放出热量为(0.5Q3-0.5Q2+1.5Q1) kJ.
答案:D
5.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ/mol、-1411.0kJ/mol和-1366.8 kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为 ( )
A.-44.2 kJ/mol B.+44.2 kJ/mol
C.-330 kJ/mol D.+330 kJ/mol
解析:由题意可知:C2H4(g)+3O2(g)―→2CO2(g)+2H2O(l)
ΔH=-1411.0 kJ/mol,C2H5OH(l)+3O2(g)―→2CO2(g)+3H2O(l) ΔH=-1366.8 kJ/mol,将上述两个方程式相减得:C2H4(g)+H2O(l)―→C2H5OH(l)
ΔH=-44.2 kJ/mol.
答案:A
4.(2010·烟台模拟)已知热化学方程式:
C(金刚石,s)+O2(g)===CO2(g) ΔH1 ①
C(石墨,s)+O2(g)===CO2(g) ΔH2 ②
C(石墨,s)===C(金刚石,s) ΔH3=1.9 kJ/mol ③
下列说法正确的是 ( )
A.石墨转化成金刚石的反应是吸热反应
B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2
D.ΔH1>ΔH2
解析:由热化学方程式③中ΔH3=1.9 kJ/mol>0得出结论石墨比金刚石稳定,A正确,B项错误,C项中,ΔH3=ΔH2-ΔH1;由于ΔH3>0,即ΔH2-ΔH1>0,ΔH2>ΔH1,D项错误.
答案:A
3.根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+O2(g)===H2O(l)ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为 ( )
A.ΔH=+244.1 kJ/mol B.ΔH=-488.3 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
解析:根据盖斯定律,将①×2+②×2-③即可得2C(s)+2H2(g)+O2(g)===CH3COOH(l),同理该方程式的反应热ΔH=2ΔH1+2ΔH2-ΔH3=-488.3 kJ/mol.
答案:B
2.白磷与氧气可发生如下反应:P4+5O2===P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ/mol、P-O b kJ/mol、P===O c kJ/mol、O===O d kJ/mol根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是 ( )
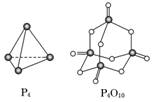
A.(6a+5d-4c-12b) kJ/mol
B.(4c+12b-6a-5d) kJ/mol
C.(4c+12b-4a-5d) kJ/mol
D.(4a+5d-4c-12b) kJ/mol
解析:由键能求反应热的公式为ΔH=反应物的键能总和-生成物的键能总和,则ΔH=6×a kJ/mol+5×d kJ/mol-(12×b kJ/mol+4×c kJ/mol)=(6a+5d-4c-12b) kJ/mol.
答案:A
1.(2010·启东中学月考)全球变暖给我们敲响了警钟,地球正面临巨大的挑战.下列说法不正确的是 ( )
A.推广“低碳经济”,减少温室气体的排放
B.推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展
C.推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油
D.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能
解析:小火力发电站对煤炭的利用率低,生产单位电力时向大气中排放的CO2气体相对较多,B不正确.
答案:B
3.词数,不少于120。
参考词汇:写生draw from nature 画板drawing board 斧 axe
Tom is a primary school student and he enjoys drawing every much.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com