
(一)制取氨气
(1)写出实验制取氨气的化学方程式_______________________________;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?________(填“能”或“否”)。
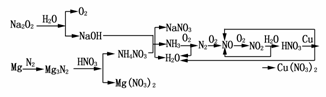
18.(2009·四川)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2?3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。

请回答下列问题:
(1)组成B单质的元素位于周期表第________周期,第________族。化合物C的电子式为________________________________________________________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是_______________________________
___________________________________________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:___________________。
(4)写出D与足量的N反应生成E和F的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有________个。
解析:B与冷水缓慢反应,与沸水迅速反应且产生H2,则B为Mg;D中阴阳离子的个数比为2?3, 且能与水生成两种碱,则D为Mg3N2;C为淡黄色固体化合物,可确定C为Na2O2或K2O2,即
且能与水生成两种碱,则D为Mg3N2;C为淡黄色固体化合物,可确定C为Na2O2或K2O2,即
答案:(1)3 ⅡA Na+[?····?····?]2-Na+或K+[?····?····?]2-K+
(2)水分子之间存在氢键且化硒化氢的分子间作用力强
(3)4NH3+3O22N2+6H2O
(4)Mg3N2+8HNO3===3Mg(NO3)2+2NH4NO3
(5)2
19. (1)某学生课外活动小组利用如图所示装置分别做如下实验:
(1)某学生课外活动小组利用如图所示装置分别做如下实验:
①在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________。
②在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________________________________________________________________
________________________________________________________________________。
(2)实验室可用如图所示装置(缺少收集装置,夹持固定装置部分略去)制备并收集NH3。
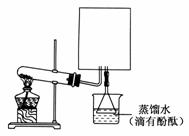
 ①在图中方框内绘出用烧瓶收集NH3的仪器装置简图。
①在图中方框内绘出用烧瓶收集NH3的仪器装置简图。
②试管中的药品是________(填写化学式)。
答案:(1)①稀氨水和酚酞 稀氨水中的NH3逸出
②溶有SO2的品红 SO2气体逸出,品红溶液恢复红色
 (2)①如右图所示。②NH4Cl、Ca(OH)2
(2)①如右图所示。②NH4Cl、Ca(OH)2
20.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
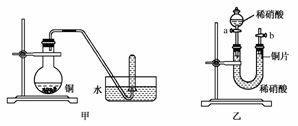
(1)写出铜和稀硝酸反应的离子方程式____________。
(2)实验装置甲能否证明 铜和稀硝酸反应的产物是NO气体________(填“能”或“不能”),请简述理由(包括化学方程式)是____________________________________。
铜和稀硝酸反应的产物是NO气体________(填“能”或“不能”),请简述理由(包括化学方程式)是____________________________________。
(3)若用实验装置乙进行实验,检查装置乙气密性的操作是:____________________。
解析:(2)当烧瓶中有空气存在时,NO与O2会生成NO2,不能判断稀HNO3与Cu反应的产物。用乙装置进行实验时,可防止有O2与NO混合,干扰实验,所以乙装置能达到实验目的。
答案:(1)3Cu+8H ++2NO===3Cu2++2NO↑+4H2O
++2NO===3Cu2++2NO↑+4H2O
(2)不能 因为烧瓶内有氧气,能氧化NO气体生成红棕色的NO2,2NO+O2===2NO2
(3)关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少量水后漏斗中的水不再下滴,则说明该装置的气密性良好
21.(2009·江西省南昌二中高三第四次阶段考试)某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
17.(2009·江苏)下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 ( )

|
物质 |
|
|
|
|
选项 |
a |
b |
c |
|
A |
Al |
AlCl3 |
Al(OH)3 |
|
B |
HNO3 |
NO |
NO2 |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
解析:本题要特别注意物质之间的相互转化通过一步反应就能实现这个限制条件。如A项中Al(OH)3→Al,C项中H2SiO3→Si,D项中CH3CHO→CH2=CH2这三种变化都不能只通过一步反应而形成。B项:HNO3NO+O2+H2ON+O2+H2OO2。
答案:B
22.4 L 11.2 L
则x=1。
答案:A
16.(2009·宁夏)将22.4 L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积为11.2 L(体积均在相同条件下测定),则该氮氧化合物的化学式为 ( )
A.NO2 B.N2O2
C.N2O D.N2O4
解析:设氮的氧化物为NxOy,则
2NxOy+2yCuxN2+2yCuO
2 x
15.(2009·重庆)下列叙述正确的是  ( )
( )
A.SO2具有还原性,故可作漂白剂
B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价
解析:A项:SO2作漂白剂是其能与色素发生化合反应;B项:Na先与H2O反应,生成的NaOH再与MgCl2反应;D项如Fe+SS。
答 案:C
案:C
14.将Mg、Cu组成的混合物26.4 g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96 L,向反应后的溶液中加入过量的5 mol·L-1的NaOH溶液300 mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A.43.2 g B.46.8 g
C.53.6 g D.63.8 g
答案:B
13.(2008·上海高考)如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不 相符的是 ( )
相符的是 ( )
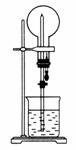
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
 D.HCl(AgNO3溶液)/白色喷泉
D.HCl(AgNO3溶液)/白色喷泉
解析:CO2与NaHCO3不反应且CO2在NaHCO3溶液中的溶解度很小,因此,CO2与NaHCO3溶液不会产生喷泉,故A项符合题意;NH3极易溶于水且氨水呈碱性,因此,NH3与含酚酞的H2O会产生红色喷泉,故B项不符合题意;H2S+CuSO4===CuS↓+H2SO4,由于CuS为黑色沉淀,因此,H2S与CuSO4溶液会产生黑色喷泉,故C项不符合题意;HCl+AgNO3===AgCl↓+HNO3,由于AgCl为白色沉淀,因此,HCl与AgNO3溶液会产生白色喷泉,故D项不符合题意。
答案 :A
:A
12.(2009·蚌埠模拟)将NO2、NH3、O2的混合气体26.88 L通过稀硫酸 后,溶液质量增加45.75 g,气体体积缩
后,溶液质量增加45.75 g,气体体积缩 小为2.24 L,将带火星的木条插入其中,木条不复燃。则原混合气体的平均相对分子质量为(气体体积均在标准状况下测定) ( )
小为2.24 L,将带火星的木条插入其中,木条不复燃。则原混合气体的平均相对分子质量为(气体体积均在标准状况下测定) ( )
A.31.667 B.35.785
C.38.125 D.40.625
解析:由题意知混合气体的总物质的量为:=1.2 mol,由于最后剩余的2.24 L气体不能让带火星的木条复燃,应为NO,所以混合气体的总质量为H2SO4溶液增加的质量与2.24 L NO质量之和。m总=45.75 g+×30 g/mol=48.75 g,则平均相对分子质量为:M===40.625 g/mol。
答案:D
11.(2009·合肥模拟)如图所示,向一定量的铁粉中加入一定体积12 mol·L-1的HNO3,加热充分反应后,下列微粒在体系中一定大量存在的是 ( )
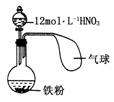
①NO ②Fe3+ ③H+ ④NO
⑤NO2
A.① B.①⑤
C.②④⑤ D.①②③⑤
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com