
1、A 2、CD 3、D 4、B 5、(1)C,B;(2)D,A
讲析:5.分析四个反应特征: A.气体质量减小,气体物质的量减少(S为非气体);B.气体质量不变,气体物质的量减少;C.气体质量不变,气体物质的量不变;D.气体质量不变,气体物质的量增大。
新活题网站
6.到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
(3)有下图所示的装置:
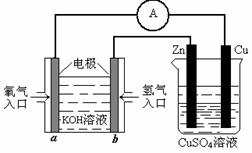 该装置中Cu极为 极;当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为
该装置中Cu极为 极;当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为
L。
5.氨是一种重要的化工原料,氨的的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中,N2+3H2 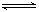 2NH3 △H<0
2NH3 △H<0
①该反应的平衡常数K的表达式为:K=______。升高温度,K值 (填“增大”、“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3 ) 。分析表中数据, ℃ MPa时H2转化率最高,实际工业生产不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 。(填字母)
A.使用催化剂可以提高NH3的产率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极电极反应式 ,你认为电解质溶液应显 性(填“酸性”、“中性”、“碱性”),其原因是 。
4. “关注民生”和“科学发展”是“十七大”报告的主题之一,环境问题与“民生”和“科学发展”密切相关。世界
“关注民生”和“科学发展”是“十七大”报告的主题之一,环境问题与“民生”和“科学发展”密切相关。世界
环保组织2006年度报告指出,在所有衡量地球健康状况的指标中,人类仅成功地扭转了一项指标的恶化-大气中氯氟烃减少,而C、S、N氧化物的排放有增无减,水资源的紧缺和污染加剧。保证经济走可持续发展的道路,是化学工作者应尽的职责所在。 回答下列问题:
(1)大气中氯氟烃的减少带来的积极效果是__________;
(2)酸雨的化学特征是 。空气中硫氧化物和氮氧化物是形成酸雨的主要物质。若用NOx表示氮氧化物,请写出空气中氮氧化物形成酸雨的化学方程式_________;
(3)SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:
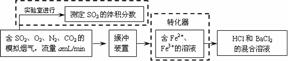
① 在实验室测定模拟烟气中SO2的体积分数,现有注射器、洗气瓶、导管、量筒等仪器,需要的药品有
______________________________________________;
② 若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,已知气体流速,还需测定的数据是
_______________________________________________;
(4)水体富营养化是导致水体藻类大量繁殖的主要因素。2007年春夏之交我省无锡太湖蓝藻事件再次给水资源保护敲响警钟。检测显示,蓝藻爆发时太湖全湖N、P平均含量分别高达4.0和0.13 mg/L。环境专家建议用金属镁将水体中的NO3-还原为N2而消除污染,Mg则转变为Mg(OH)2沉降湖底。要使太湖水中N的平均含量下降至0.20 mg/L,则每立方米水体中应投入的镁粉应不少于 g。
3.碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
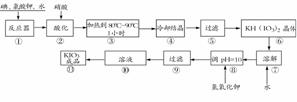
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是
_______________________________________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为___________________________________;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是_________________________________。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
2.氯气是很重要的工业原料,很多化学物质成分中均含有氯,如饮用水消毒常用的消毒剂;三氯化磷是无色液体,是重要的化工原料,可用来制造许多磷的化合物,如敌百虫等多种农药。科学家舍勒在化学上的另一个重要的贡献是发现了氯气。一般情况下,在实验室中常用较强的氧化剂[如MnO2、PbO2、KMnO4、KClO3、Ca(ClO)2等]氧化盐酸制氯气。
(1)写出用PbO2和浓盐酸反应制备氯气时的化学方程式_________________________。铅元素在元素周期表中位置是__________________;已知PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应时的离子方程式 。
(2)现用漂粉精和浓盐酸反应制备氯气。将足量漂粉精投入浓盐酸中。反应中涉及到的化学方程式可能有 、 。
(3)磷在氯气中燃烧可生成无色液体PCl3和淡黄色晶体PCl5,PCl3还可继续与Cl2作用生成PCl5,PCl3和PCl5均可与水反应:PCl3+3H2O=H3PO3+3HCl,PCl5+H2O=POCl3+2HCl, PCl5+4H2O=H3PO4+5HCl。PCl5受热可分解:PCl5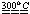 PCl3+Cl2。
PCl3+Cl2。
①将红磷(P)与Cl2按规定2:5物质的量之比放在密闭容器中,加热至5000C发生反应,所得产物主要是_______________;
②已知PCl3分子为三角锥形结构,键角为1000,H3PO3与足量NaOH溶液作用的产物是Na2HPO3,则在下列物质的分子中各原子的最外层均达到了八个电子结构的是___________。
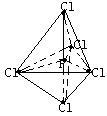 A.PCl3 B.PCl5 C.Na2HPO3 D.Na3PO4
A.PCl3 B.PCl5 C.Na2HPO3 D.Na3PO4
③已知PCl5分子为三角双锥结构的非极性分子,则PCl3F2有_____种同分异构体。
④水在液态时存在H3O+和OH-,液氨中存在少许NH4+和NH2-,PCl5在一定条件下也存在类似水和氨的解离方式,其中一种离子呈四面体结构。则两种离子分别是_______和________。
1.国家环保总局“2006年环境监测公报”指出,减少SO2的排放和生活废水的处理是我国“十一五”期间环境保护的主要任务。请回答下列问题:
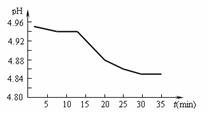
(1)SO2的排放是造成酸雨的主要因素。某地区酸雨pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因 。
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+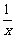 Sx 、CO+
Sx 、CO+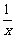 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+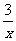 Sx 。其中COS分子的空间构型为 。
Sx 。其中COS分子的空间构型为 。
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
2.已知常温下,Mg(OH)2在其饱和溶液中的物质的量浓度为1.65×10-4 mol· L-1,Ag2O的溶解度是目1.6×10-3 g/100 g H2O,通过计算判断:
(1)将足量MgO和Ag2O分别放入水中,其水溶液能否使酚酞变红?(已知lg 3.3=0.5,l g 1.4=0.2)。
(2)取MgSO4稀溶液,加入适量NaHCO3稀溶液,并使NaHCO3与MgSO4的物质的量之比为2∶1,试回答:
①经检测,该溶液的pH=7.5,其原因是______________
_______________________________________________。
②在混合液中滴入酚酞,然后在水浴中加热至约60℃,其现象是___________,离子方程式是______________________________。待充分反应后,再升高温度在沸水浴中加热,其现象是___________,化学方程式是________________。
[课后巩固]
1.红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:①铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)②焙烧产物加水后,并用硫酸调成中性溶液③过滤、滤液加硫酸酸化、浓缩、结晶成红矾。
(1)完成下列化学方程式:
SiO2+CaCO3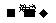 ;
;
Al2O3+Na2CO3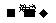 _____________________。
_____________________。
(2)配平下列反应方程式,填上系数:
FeO·Cr2O3+ Na2CO3+ O2 ¾
Na2CrO4+ Fe2O3+ CO2
(3)用水浸取焙烧产物,并用硫酸调成中性的目的是
,并写出有关的离子方程式 。
21.(本题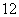 分)已知定义在
分)已知定义在 上的函数
上的函数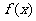 有
有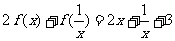 .
.
⑴求函数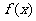 的解析式;
的解析式;
⑵设函数 ,直线
,直线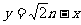 (
(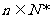 )分别与函数
)分别与函数
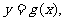
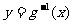 交于
交于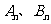 两点(
两点(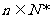 ).设
).设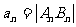 ,
,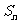 为数列
为数列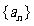
的前n项和。
①求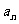 ,并证明
,并证明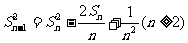 ;
;
②求证:当 时,
时,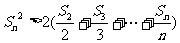 。
。
秘密★启用前
重庆一中高2010级高三上期第一次月考
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com