
3. -Do you know __________ this dictionary belongs to?
- Let me see. Oh, it’s __________.
A. who, mine B. who, me C. whose, mine D. whose, me
2. -When did the terrible earthquake in Wenchuan happen?
-It happened __________2:28 __________the afternoon of May 12, 2008.
A. on, in B. at, on C. at, in D. on, on
1. -How far is it from this hotel to _______ station?
-It is _______ eleven-kilometer walk from here.
A. the; an B. /; an C. /; / D. the; a
14.(11分)下表是不同温度下水的离子积的数据:
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是____________________________________________________________.
(2)25℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________.
(3)在t2温度下测得某溶液pH=7,该溶液显______(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a∶b=________.
②若所得混合液pH=2,则a∶b=________.
解析:(1)升高温度,促进水的电离,水的离子积常数增大.
(2)c(Na+)==1.0×10-4 mol/L,而25℃时水电离出来的c(OH-)=1.0×10-7 mol/L,所以c(Na+)∶c(OH-)=1.0×10-4∶1.0×10-7=1000∶1.
(3)t2温度下,pH=6的溶液呈中性,则pH=7的溶液显碱性.
①若所得混合液为中性,即n(H+)=n(OH-),
1×10-1 mol/L×b L= mol/L×a L,则a∶b=1∶1.
②若所得混合液pH=2,即酸过量,
c(H+)=
=1×10-2 mol/L,则a∶b=9∶11.
答案:(1)> 温度升高,水的电离程度增大,离子积增大
(2)1000∶1 (3)碱 ①1∶1 ②9∶11
13.(17分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
(1)正确的操作步骤是(填写字母)
________→________→________→D→________.
(2)滴定管读数应注意_____________________________________________
________________________________________________________________________.
(3)操作中锥形瓶下垫一张白纸的作用是_______________________________
________________________________________________________________________.
(4)操作D中液面应调整到_________________________________________;
尖嘴部分应__________________.
(5)滴定到终点时锥形瓶内溶液的pH约为_____________________________;
终点时的颜色变化是________.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”,其他操作均正确).
(7)该烧碱样品的纯度计算式是_______________________________________.
解析:(1)本题应先配制250 mL NaOH溶液,取25.00 mL于锥形瓶中,用H2SO4溶液进行滴定,故正确的操作步骤是C→A→B→D→E.
(2)滴定管读数时,滴定管要垂直,装液和放液后需等一会,待液面不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数读到0.01 mL.
(3)放一张白纸有利于准确判断滴定终点时溶液的颜色变化情况.
(4)调整液面时应调至零刻度或零刻度以下某一刻度,尖嘴部分应充满溶液,无气泡.
(5)滴定时锥形瓶内溶液的pH由大变小,终点时pH约为3.1-4.4,溶液颜色由黄色变为橙色.
(6)若酸式滴定管没有用标准H2SO4溶液润洗,则滴定时消耗H2SO4溶液的体积偏大,所测烧碱溶液的浓度偏高.
(7)滴定时消耗溶质H2SO4的物质的量为 mol,则反应掉NaOH的物质的量为 mol.NaOH的纯度为:×100%=
%.
答案:(1)C A B E
(2)滴定管垂直;装液和放液后需要等一会,等液面上下不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数应到0.01 mL
(3)便于准确判断滴定终点时溶液的颜色变化情况
(4)零刻度或零刻度以下的某一刻度 充满溶液,无气泡 (5)3.1-4.4 由黄色变为橙色
(6)偏高 (7)%

12.(13分)(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者______后者(填“<”、“>”或“=”).
(2)常温下,0.1 mol/L的醋酸和pH=1的醋酸各100 mL,分别与足量的锌粒反应,产生的气体前者比后者________.
(3)在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)________.
A.5 B.7
C.3-5之间 D.5-7之间
(4)25℃时,向0.1 mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将________.
A.增大 B.减小
C.不变 D.无法确定
(5)室温下,向0.1 mol/L的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入________试剂.
A.碳酸钠晶体 B.醋酸钠晶体
C.滴加少量硫酸铜溶液 D.水
解析:(1)醋酸、盐酸均是一元酸,体积、浓度均相等,则提供等量H+,产生气体的体积相等.
(2)醋酸是弱酸, pH=1的醋酸浓度要远大于0.1 mol/L,故等体积时与足量Zn反应,pH=1的醋酸产生氢气多.
(3)pH=5的氯化铵溶液稀释100倍后,浓度变小,水解程度增大,因此H+浓度小于10-5 mol/L而大于10-7 mol/L,即选D.
(4)加入醋酸钠晶体,使醋酸电离平衡向逆向移动,H+浓度减小,故pH增大.
(5)减慢H2产生速率,但不影响产生H2体积,则可减小H+浓度,但不减少H+的
物质的量,故选B、D.
答案:(1)= (2)少 (3)D (4)A (5)BD
11.(9分)中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:
H2O+H2O H3O++OH- ΔH>0
H3O++OH- ΔH>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是________(填字母).
A.向水中加入NaHSO4
B.向水中加入NaCO3
C.加热水至100℃[其中c(H+)=1×10-6 mol/L]
D.在水中加入(NH4)2SO4
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显________色,溶液呈________性(填“酸”、“碱”或“中”);若用pH计测定,则pH________7(填“>”、“<”或“=”),溶液呈________性(填“酸”、“碱”或“中”).
解析:(1)A中加入NaHSO4后,c(H+)增大,水电离平衡逆移;B中加入Na2CO3,消耗H+,平衡正移,溶液呈碱性;C中平衡正移,但溶液依然为中性;D中加入(NH4)2SO4,消耗OH-,平衡正移且呈酸性.
(2)沸水仍呈中性,故用pH试纸测定应呈本来颜色;若用pH计测定,应小于7.
答案:(1)D (2)淡黄 中 < 中
10.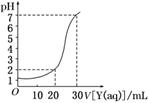 (2010·衡水模拟)如图为对10 mL一定物质的量浓度的盐酸X
(2010·衡水模拟)如图为对10 mL一定物质的量浓度的盐酸X
用一定物质的量浓度的NaOH溶液Y滴定的图象,依据图象
推出X和Y的物质的量浓度是下表内各组中的 ( )
|
|
A |
B |
C |
D |
|
X/mol/L |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y/mol/L |
0.04 |
0.12 |
0.09 |
0.03 |
解析:由图知,30 mL NaOH溶液恰好中和10 mL盐酸,即3c(Y)=c(X),表中A、D属此种情况,但A组中c(X)=0.12 mol/L,c(H+)=0.12 mol/L,pH<1,与图不符.D组中X=0.09 mol/L,pH>1,加入20 mL NaOH溶液后的
c(H+)==1×10-2 mol/L,pH=-lg(1×10-2)=2,符合题意.
答案:D
9.(2010·凤阳模拟)下列四种溶液:
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.
相同条件下,有关上述溶液的比较中,正确的是 ( )
A.由水电离的c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
解析:加入酸、碱都会抑制水的电离.因CH3COOH、HCl中c(H+)与氨水、NaOH溶液中c(OH-)相同,对水电离的抑制程度相等,A错误.将②③混合若pH=7,则消耗溶液的体积②>③,B正确.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最多,C错误.向等体积的四种溶液中分别加入100 mL水后溶液pH大小关系应为③>④>②>①,D错误.
答案:B
8.已知在100℃的温度下(本题涉及的溶液温度均为100℃),水的离子积KW=1×10-12.下列说法正确的是 ( )
A.0.05 mol/L的H2SO4溶液pH=1
B.0.001 mol/L的NaOH溶液pH=11
C.0.005 mol/L的H2SO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
解析:解答本题需注意题中涉及的溶液温度为100℃,而不是25℃,此时KW=1×10-12 .A项,c(H+)=0.05 mol/L×2=0.1 mol/L,pH=1,A项正确;B项,c(OH-)=0.001 mol/L,c(H+)==1×10-9 mol/L,pH=9,B项不正确;C项,H2SO4溶液中c(H+)=0.005 mol/L×2=0.01 mol/L,NaOH溶液中c(OH-)=0.01 mol/L,两溶液等体积混合后,恰好完全中和,溶液显中性,pH为6,C项不正确;D项,pH=3的H2SO4溶液中c(H+)=10-3 mol/L,pH=11的NaOH溶液中c(OH-)==1×10-1 mol/L,则50 mL×10-3 mol/L=V(NaOH)·10-1 mol/L,V(NaOH)=0.5 mL,D项不正确.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com