
15.解析:本题考查由物理性质特征推知晶体类型以及如何区别不同晶体的微粒间作用力。此题为信息迁移题,解答时先由氮化硅的性质(超硬、耐磨、耐高温),可推知是原子晶体。原子晶体熔化时,要克服共价键。然后分析比较各选项。答案B。
8.D 根据干冰结构特点,干冰晶体是一种立方面心结构,每个CO2周围等距离最近的CO2有12个(同层4个,上层4个,下层4个)
7.D 根据金刚石的棱型结构特点可知最小环上碳原子数为6个,任意两个C-C键间夹角为109°28
6.[解析]HF、HCl、HBr、HI热稳定性依次减弱是它们的共价键键能逐渐减小的原因,与键能有关。NaF、 NaCl、NaBr、NaI的熔点依次减低是它们的离子键能随离子半径增大逐渐减小的原因。F2、C12、Br2、I2为分子晶体。熔、沸点逐渐降低由分子间作用力决定。H2S与H2O的熔沸点高低由分子间作用力及分子的极性决定。故选C、D。
5.[解析]干冰是分子晶体,分于内存在共价键,分子间存在范德华力。NaCl是离子晶体只存在离子键。 NaOH是离子晶体,不仅存在离子键,还存在H-O间共价键。碘也是分子晶体,分子内存在共价键,分子间存在分子间作用力。故只有B符合题意。
1.D 2.B 3.A 4.D 5.D 6.CD 7.D 8.D 9.C 10.BD 11.C 12.D 13.A 14.C 15.B 16.A
19.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在13000C反应获得。
(1)氮化硅晶体属于______________晶体。
(2)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式_______.
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的氮化硅。反应的化学方程式为_________________.
]第二节 分子晶体与原子晶体 答案
18.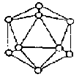 右图为晶体硼的基本结构单元,已知它为正二十面体(有二十个等边三角形和一定数目的顶角),每一个顶点各有一个硼原子,通过观察,此基本结构单元由多少硼原子构成?
右图为晶体硼的基本结构单元,已知它为正二十面体(有二十个等边三角形和一定数目的顶角),每一个顶点各有一个硼原子,通过观察,此基本结构单元由多少硼原子构成?
17. 右图为金刚石的晶体结构。每个C原子、每条C-C键被多少个六元环共用?
右图为金刚石的晶体结构。每个C原子、每条C-C键被多少个六元环共用?
16.碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石②晶体硅③碳化硅中,它们的熔点从高到低的顺序是( )
A. ①③② B. ②③① C. ③①② D. ②①③
[拓展提高]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com