
4.(江苏省南京市2009届高三年级质量检测)选做题(共计12分)本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”
两个选修课程模块的内容,每题12分。请选择其中一题作答,并把所选题且对应字母
后的方框涂黑。若两题都作答,将按A题评分。
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式 ;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是
。
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为 ;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 。
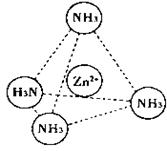
(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;

该化合物的晶体熔点比干冰高得多,原因是 。
答案.
(1)1s22s22p63s23p63d10 sp2、sp3

(2)三角锥形
(3)ZnX 该化合物是原子晶体,而干冰是分子晶体。
3.(江苏省前黄高级中学2008-2009学年第一学期高三期中试卷)下列有关物质类别判别的依据中,正确的是[ C]
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.酸性氧化物:能否与碱反应
2.(12分)
(A)(江苏省2009年高考化学模拟测试试卷)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。
N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可
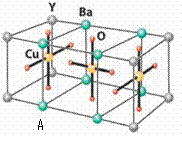
溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 ▲ 。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为 ▲ 。
(3)HN3属于 ▲ 晶体,与N3-互为等电子体的分子的化学式为 ▲ (写1种)。
NH2-的电子式为 ▲ ,其中心原子的杂化类型是 ▲ 。
(4)CuCl2-中的键型为 ▲ ,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为 ▲ 。
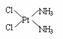
 (5)治癌药物B的结构简式为
▲
。
(5)治癌药物B的结构简式为
▲
。

答案(1)
(2)N>P>S
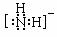
(3)分子, CO2 (N2 COS CS2,写1个即可), sp3
(4) 配位键(写共价键也可) 7mol
(5)
1.(江苏省奔牛高级中学2008-2009学年度高三第二次调研)(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
A |
|
|
|
|||||||||
|
|
|
B |
|
|
C |
|
|
||||||||||
|
|
|
|
|
|
|
D |
E |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ;
(2)D、E两元素的部分电离能数据列于下表:
|
元 素 |
D |
E |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是 ;
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 。
(4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
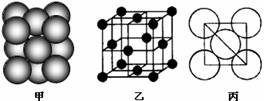
答案(12分)(1)1s22s22p63s23p63d54s2 (2分)
(2)Mn2+的3d轨道电子排布为半满状态较稳定 (2分)
(3)sp3 (2分) V型(或角型)(2分)
(4) 12 (2分) 4 (2分)
4.芳香烃的来源及其应用
知识梳理
⒈结构知识
苯的分子式 结构简式 或 苯的空间结构
苯 使高锰酸钾酸性溶液褪色, 使使溴的四氯化碳溶液褪色(填“能”或“不能”)
苯分子中碳碳键长完全相等,而且介于碳碳单键和碳碳双键之间,是一种特殊的化学键。
思考:可以从哪些几个方面来证实?
⑴苯分子是一个平面正六边形的结构,既然是正六边形,所以所有的碳碳键的键长都是相等的;
⑵将苯加入到溴水中不会因反应而褪色;
⑶将苯加入到高锰酸钾酸性溶液中时溶液不褪色
⑷如果苯分子为单双键交替排列的结构,邻二氯取代物应有2种。而事实上苯的邻二氯取代物只有1种,说明苯分子中的碳碳键是完全相同的。
⒉苯的物理性质:无色、有 气味的 ;密度比水 ;不溶于水,易溶于有机溶剂,有毒,易挥发。
⒊苯的化学性质:(易取代,难加成)
苯的取代反应--卤代反应、硝化反应(各写出反应方程式并注明反应条件)
卤代反应:
硝化反应:
苯的加成反应 (各写出反应方程式并注明反应条件)
加成反应:
苯的氧化反应(燃烧) 现象:
解释:
⒋苯的同系物:定义 通式
化学性质:苯环对侧链取代基的影响--能使酸性高锰酸钾溶液褪色,侧链基被氧化
侧链取代基对苯环的影响--使得取代基的邻位和对位的C-H易断裂
例如 甲苯和浓硫酸、浓硝酸的混合酸的反应 (写出化学方程式)
⒌芳香烃从前通过提炼煤炭获得,现在通过石油的催化重整。
试题枚举
[例1]苯环结构中,不存在单双键交替结构,可以作为证据的事实是①苯不能使酸性KMnO4溶液褪色;②苯中碳碳键的键长均相等;③苯能在一定条件下跟H2加成生成环己烷;④经实验测得邻二甲苯仅一种结构;⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色
A、②③④⑤ B、①③④⑤
C、①②④⑤ D、①②③④
解析:在苯分子中没有单、双键交替的结构,而是一种介于单键和双键之间的一种特殊
的价键,如果有单、双键交替结构苯应该能使酸性KMnO4溶液褪色;碳碳键的键
长应不相等(单键和双键键能不同,键长也不同);邻二甲苯应有两种结构;遇溴、
溴水因加成反应而使其褪色。
答案:C
[变式] X是一种烃,它不能使KMnO4溶液褪色.0.5摩的X完全燃烧时,得到27克水和67.2
升CO2(标准状况).X是( B )
A.环己烷 B.苯 C.1,3一己二炔 D.甲
[例2](2000年春,13)萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为
2-硝基萘,则化合物(Ⅲ)的名称应是

A.2,6-二甲基萘 B.1,4-二甲基萘
C.4,7-二甲基萘 D.1,6-二甲基萘
解析: (Ⅰ)中1、4、5、8四个碳原子的位置是等同的,其中任何一个位置都
可定为1,则另三个分别为4、5、8。再由命名时,支链位置之和最小的原则,(Ⅲ)
的名称为1,6-二甲基萘。
答案:D
[例3](1999年全国,17)下列有机分子中,所有的原子不可能处于同一平面的是
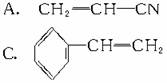
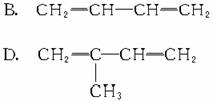
解析:乙烯和苯都是平面型分子,所有原子都在同一平面内,A、B、C三种物质中分别
可以看作乙烯分子中的一个氢原子分别被-CN、-CH==CH2、
取代,所以所有原子仍有可能在同一平面内。而D中物质可以认为是CH4分子中的一个氢原子被 取代,故所有原子不可能处于同一平面内。
取代,故所有原子不可能处于同一平面内。
 答案:D
答案:D
[变式]下列关于HC≡C CH2-CH=CHCH3的说法正确的是 ( A )
A.所有C原子可能共平面
B.除苯环外的C原子共直线
C.最多只有4个C共平面
D.最多只有3个C共直线
[例4]烷基取代苯 R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成 COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到
COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到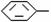 COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为 COOH的异构体共有7种,其中的3种是
COOH的异构体共有7种,其中的3种是 CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3,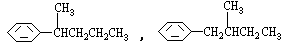 请写出其他4种的结构简式:_____________________________________________________________________________________________________________。
请写出其他4种的结构简式:_____________________________________________________________________________________________________________。
解析:该题给出了解题的相关信息,除苯环外还有五个碳,可以从戊基的同分异构体中找满足条件的,然后加到苯环上。
 答案:
答案:
3.苯的同系物的某些化学性质
2.了解芳香烃的概念
1.苯的组成和结构特征,掌握苯的主要性质。
19.[解析] (1)这是一道信息题,从题给信息知氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,应是原子晶体。
(2)氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子, Si原子和Si原子不直接相连,同时每个原子都满足8电子稳定结构,因此氮化硅的化学式为Si3N4。
强热
(3)3SiCl4 + 2N2 +6H2=== Si3N4 + 12HCl。
16.[解析] 此题是给出新情境的信息迁移题。给出的新情景。是碳化硅的一种晶体具有类似金刚石的结构;此题的考查内容,是化学键与晶体结构。所列三种晶体均是原子晶体,结构相似,晶体内的结合力是呈空间网状的共价键:
共价键键长:C-C键< C-S键 < S-S键
共价键键能:C-C键> C-S键 > S-S键
共价键键长越短,键能越大,则原子晶体的熔点越高。所以三者的熔点由高到低的顺序是:金刚石、碳化硅、晶体硅。[答案] A。
17解析:任意两条相邻的C-C键参加了2个六元环的形成,每个C原子可形成4条C-C键,两面相邻的组合有C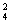 =6种,故每个C原子被6×2=12个六元环共用。而每条C-C键可以与相邻的3条C-C键两两相邻,故每条C-C键被3×2=6个六元环共用。
=6种,故每个C原子被6×2=12个六元环共用。而每条C-C键可以与相邻的3条C-C键两两相邻,故每条C-C键被3×2=6个六元环共用。
18解析:该晶体的晶胞由二十个等边三角形构成,而每个等边三角形有3个顶点,这样共有20×3=60个顶点,但每个顶点又被相邻的5个等边三角形所共有,所以该晶胞实际拥有的顶点数应为:
20×3×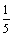 =12个。
=12个。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com