
3.下列函数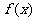 中,满足对任意
中,满足对任意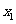 ,
,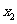
 (0,
(0, ),当
),当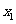 <
<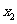 时,都有
时,都有 >
>
的是( )
A.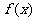 =
=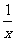 B.
B. 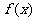 =
= C .
C .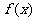 =
= D.
D. 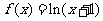
2.若集合 ,则
,则 ( )
( )
A. 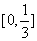 B.
B. 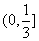 C.
C. D.
D.

1.函数 的定义域为( )
的定义域为( )
A.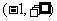 B.
B. C.
C. D.
D.
12.(江苏省口岸中学09届秋学期高三年级第二次月考)阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是[ A]
A.0.5g C3H4中含有共用电子对的数目为0.1×6.02×1023
B.3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1×6.02×1023
C.25℃时pH=1的醋酸溶液中含有H+的数目为0.1×6.02×1023
D.标准状况下,2.24L CHCl3含有的分子数为0.1×6.02×1023
13 (江苏省口岸中学09届秋学期高三年级第二次月考)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。
(2) 写出下列有关反应的化学方程式:
① E的单质与I元素的最高价氧化物对应的水化物反应:
;
②H2C2与EC2反应:
。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式)。元素I、J形成的化合物可能是什么晶体 。比元素B原子序数大5的元素基态原子电子排布式是 。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中E元素原子以 和 杂化成键,分子中共形成 个σ键, 个π键。
(5)C和I相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性和挥发性 b. 单质分子中的键能
c. 两元素的电负性 d .含氧酸的酸性
e .氢化物中X-H键的键长(X代表C和I两元素) f.两单质在自然界的存在
11.(江苏省射阳中学2009届高三第二次月考) (14分)
(1)右图折线c可以表达出某一主族元素氢化物的沸点的变化规律,C线上任一物质其VSEPR模型和分子空间构型 。(填“相同”或“不同”)两位同学对某另一主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是: (填“a”或“b”);
(2)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
( )。下列关于三聚氰胺分子的说法中正确的是 。
)。下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
(3)金属是钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
(4)I.某种钾的氧化物(氧化钾、过氧化钾或超氧化钾中的一种)的晶胞如图所示(每个黑点或白空点都表示一个阴、阳离子)。则该氧化物的化学式为 。
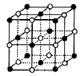
如果将1 mol该晶胞完全转化变成相应的气态离子需吸收的能量为b kJ,则该晶体的晶格能为 。
Ⅱ.如果将上图中的白点去掉并将黑球换成相应的分子或原子,可以得到干冰或
铜的晶胞,它们的配位数均为 。
答案(1)相同 b (每空1分)
(2)B(2分)
(3)I.3d24S2 (2分) II.[TiCl(H2O)5]Cl2·H2O(2分)
(4)I.KO2 kJ·mol-1 (每空2分,共6分)
10.(江苏省射阳中学2009届高三第二次月考)下列说法中正确的是:①所有基态原子的核外电子排布都遵循构造原理 ②同一周期从左到右,元素的第一电离能、电负性都是越来越大 ③所有的化学键和氢键都具有相同的特征:方向性和饱和性 ④所有的配合物都存在配位键,所有含配位键的化合物都是配合物 ⑤所有含极性键的分子都是极性分子 ⑥所有离子晶体中都含有离子键 ⑦所有的金属晶体熔点肯定高于分子晶体[ B]
A.①② B.⑥ C.③④⑤ D.①②⑥
9.(江苏省射阳中学2009届高三第二次月考)下列物质的熔、沸点高低顺序正确的是[ BC]
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>H2O>O2>N2 D.金刚石>生铁>纯铁>钠
7、(淮阳一高09高三一轮复习月考(11月份)短周期元素X、Y的原子序数相差2。下列有关叙述正确的是[ C]
A、X与Y不可能位于同一主族 B、X与Y一定位于同一周期
C、X与Y可形成分子晶体XY2 D、X与Y不能形成离子晶体XY
8 (淮阳一高09高三一轮复习月考(11月份)下列叙述正确的是 [C]
A、C60和NO2都是共价化合物
B、CCl4和NH3都是以极性键结合的极性分子
C、在NaCl和SiO2晶体中,都不存在单个小分子

D、甲烷的结构式: ,是对称的平面结构,所以是非极性分子
6、(淮阳一高09高三一轮复习月考(11月份) 设NA表示阿伏加德罗常数的值,下列说法正确的是[ D]
A、18gD2O所含电子数目为10 NA
 B、1mol甲基中所含电子数为10 NA
B、1mol甲基中所含电子数为10 NA
C、在标准状况下,含m molHCl的浓盐酸与足量MnO2反应可生成 个氯气 分子
D、在标准状况下,22.4L以任意比混合的H2S与SO2混合气体中所含气体分子数
必小于NA
5.(2008-2009学年度江苏省淮阴中学高三第三次调研测试)阿伏加德罗常数为NA,下列说法中正确的是 ( BC )
 A.1.0L 1.0 mol·L-1NaAlO2溶液中含有的氧原子数为2NA
A.1.0L 1.0 mol·L-1NaAlO2溶液中含有的氧原子数为2NA
B.在标准状况下,0.1mol的CCl4中含有C-Cl键的数目为0.4NA
C.31 g P4 (分子结构如右图)中含有的P-P键个数为1.5NA
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com