

1、C 2、C 3、(1)S=ω/(100-ω) × 100 g
(2)c=25m/V mol•L-1 (3)0.25 dω mol•L-1
(4)4c/d %
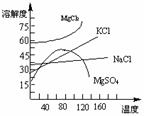
讲析:1.先计算若3.5 gNaCl能溶于6.5 gH2O,所得溶液质量分数为:
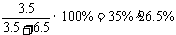
由此可知,加入的NaCl并不能完全溶解,所以溶液仍为饱和溶液。
21.Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20 mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20 mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 。
(2)根据上表数据分析,该样品 (填选项字母)
A.只含有Na2S2O3
B.含有Na2S2O3和Na2SO3两种成分
C.含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算该样品中各成分的物质的量之比。
(4)求所加硫酸溶液的物质的量浓度是多少?
|
配料 |
精盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15 mg/kg |
|
储存方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
20.(8分)由A、D、E、G四种微粒组成的盐可表示为xAaDd·yE2D·zG(其中x、y、z均为系数)。取该盐4.704克溶于水得一澄清的弱酸性溶液,其中溶质的质量为3.408克。同质量的该盐与5.13克Ba(OH)2充分混匀后加热,生成的气体用足量的铝盐溶液充分吸收得Al(OH)3为0.624克,加热后的残渣用水溶解后过滤,滤液以酚酞为指示剂用0.400摩/升的H2SO4滴定至终点,用去H2SO4为15.0毫升,滴定完毕后,溶液检测不出任何金属离子和酸根离子,滤渣用HNO3洗涤时部分溶解,得一遇石炭酸显紫色的黄色溶液,依据推理、计算,将结果填入下列空格内。 (1)A、D、E、G四种微粒分别为__________;
(2)推算x、y、z之比为____________;
(3)推算a、d之比值为___________________;
(4)该盐的化学式为________________。
19.(12分)空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。 ②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。 请你协助甲同学完成100mL5×10-4mol/L碘溶液的配制: 第一步:准确称取1.27g碘单质加入烧杯中, ; 第二步: ; 第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。 (2)乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50mL5×10-4mol/L的碘溶液,注入下图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
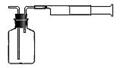 ①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原
因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:______________。 ③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案: 。 (3)改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
18.(8分)生铁中一般含有化合物B,它的含量、形状、分布对生铁性能影响很大,使生铁硬而脆,不宜进行机械加工。已知:(1)E、F、H、I、P常温下为气体,H、I、P为单质,E是一种经棕色气体。(2)反应①②均为制备理想的绿色水处理剂Na2FeO4的方法,其中反应①在生成Na2FeO4的同时还生成NaNO2和H2O。各物质之间的转化关系如下图所示(图中部分生成物没有列出)。
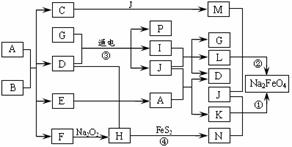
请填写以下空白:
(1)写出F的电子式_________。
(2)反应③的离子方程式为_____________________;
(3)反应①的化学方程式为_____________________。
17.(12分)海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
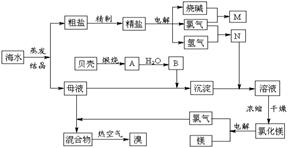
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液
C.氢氧化钠溶液 D.碳酸钠溶液
则加入试剂的顺序是(填编号) 。
(2)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为______________________。
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是 。
(4)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 。
A.精制饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(5)母液中常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品。若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是__________________;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的________晶体。
16.(12分)实验室常用草酸(H2C2O4)和浓硫酸反应(加热)制取CO:H2C2O4 H2O+CO2+CO。现进行CO的制取和还原氧化铜,并证明CO的氧化产物及测定铜的相对原子质量的实验,有关装置图如下所示:
H2O+CO2+CO。现进行CO的制取和还原氧化铜,并证明CO的氧化产物及测定铜的相对原子质量的实验,有关装置图如下所示:
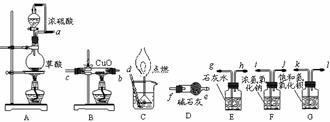
试回答:
(1)若按气流从左到右,每个装置都有用到而且只能用一次,则各仪器之间的连接顺序为(用字母编号) ;
(2)装置A中的分液漏斗与蒸馏烧瓶之间连接导管所的作用是 ;
(3)C装置导管先通入一倒置在水中的漏斗然后点燃的原因是 ;
(4)如果实验效果达到预想要求的话,E装置内的现象应为 ;G装置的作用为 ;
(5)若测知反应物CuO的质量MCuO和反应前后B管、D管、E瓶、G瓶的质量差(分别用MB、MD、ME、MG表示),且已知CuO全部参加反应,请将求算Cu的原子量的数据组合和表达式填入下表(不一定填满):
|
数据组合 |
Cu的相对原子质量的表达式 |
|
|
|
|
|
|
(6)若去掉D装置,则应选用(5)中哪组数据组合求得的铜的相对原子质量较精确? 。
15.(10分)某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失。大家经查阅资料后,发现可能的原因是发生了下列反应:AgI+I- [AgI2]-。
[AgI2]-。
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验。
实验1:向浓KI溶液中滴加AgNO3溶液,现象为 。
实验2:向AgNO3溶液中滴加稀KI溶液,有黄色沉淀生成;再 。
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀。请解释出现沉淀的原
因 。
(3)丙同学在实验所得的溶液中滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀
的颜色。大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是 ;请设计简单的实验说明不会产生AgCl沉淀:____________________
。
14.把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的物质的量之比 |
8:1 |
9:2 |
1:8 |
2:9 |
|
原稀盐酸的物质的量浓度(mol/L) |
3.4 |
1.1 |
1.8 |
1.3 |
第Ⅱ卷(非选择题,共72分)
13.11.9g金属锡跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氧化产物可能是
A.SnO2·4H2O B.Sn(NO3)4
C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com