
10.(08年广东化学·1)2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于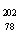 Pt的说法正确的是A
Pt的说法正确的是A
A.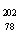 Pt和
Pt和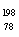 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B.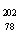 Pt和
Pt和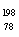 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C.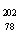 Pt和
Pt和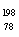 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D.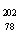 Pt和
Pt和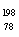 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
答案:A
解析:同位素定义:质子数相同,中子数不同的核素称为同位素。
9.(08年宁夏理综·11)短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2mol ECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
A.E是一种非金属元素 B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2 D.E位于元素周期表的IVA族
答案:D
解析:n(AgCl)==0.4mol,由Cl-守恒得n=2,所以E为+2价,属于ⅡA族元素,即E为金属元素,ECln的熔点为-78℃,沸点为59℃,属于分子晶体,所以在ECln中E与Cl之间形成共价键。
8.(2007海南·2)下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.1和17 B.12和9 C.14和 6 D.15和8
答案:B
考点:本题考查了原子结构与离子键的含义。
解析:本题可以根据原子序数写出化学式即A、HCl B.MgF2 C.SiC D.P2O5 写出化学式后,很容易看出只有MgF2 是离子化合物,存在离子键。
7.(07年广东理基·24)下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
答案:C
解析:Li、Na、K元素处于同一主族,原子核外电子层数随着核电荷数的增加而增多,金属性逐渐增强,故A选项正确、C选项错误;同于周期从左到右金属性逐渐减弱,非金属性逐渐增强,因此第二周期元素从Li到F,非金属性逐渐增强,正确;O与S为同主族元素,且S的核电荷数大于O,因此O的非金属性比S强,正确。
6.(07年广东理基·23)下列物质中含离子键的是
A.Cl2 B.CO2 C.NaCl D.CH4
答案:C
解析:只有离子化合物中才含有离子键,题目给出的各个选项中只有C选项中的NaCl为离子化合物。其余各选项中的物质均含有共价键。
5.(07年广东理基·21)32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
答案:D
解析:32S与33S原子为同一种元素(S元素)的不同核素,因此他们的最外层电子数、核外电子数和质子数均分别相等,分别为6、16和16;而他们的中子数和质量数不同。故正确答案为D。
4.(07年广东化学·17)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
答案:B
解析:难度,中等。此题是传统的元素推断题,由题意分析可知:X、Y、Z最外层电子数之和为13,13/3〉4,Z原子最外层电子数最多,又是3的整数倍。故Z最外层电子数为6,只能是S,Y与Z同周期,最外层电子数为2,故为Mg, X、Y、Z原子的最外层电子数之和为13,X内层电子数为2,由此可知X为N。
3.(07年广东化学·13)顺式Pt(NH3)2Cl2(式量为300)是临床广泛使用的抗肿瘤药物。下列有关该物质的说法中正确的是
A.由4种元素组成
B.含有NH3分子
C.Pt的化合价为+4
D.Pt元素的质量百分含量为65%
答案:AD
解析:题目以临床医学广泛使用的搞肿瘤药物为背景考查学生对物质类别及组成的认识。Pt(NH3)2Cl2药物组成不可能有NH3分子,否则会逸出且NH3有毒,故B错。因NH3为0价,故Pt为+2价,C错。
2.(07年广东化学·1)铋(Bi)在医药方面有重要应用。下列关于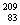 Bi和
Bi和 Bi的说法正确的是
Bi的说法正确的是
A.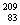 Bi和
Bi和 Bi都含有83个中子
Bi都含有83个中子
B.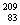 Bi和
Bi和 Bi互为同位素
Bi互为同位素
C.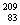 Bi和
Bi和 Bi的核外电子数不同
Bi的核外电子数不同
D.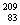 Bi和
Bi和 Bi分别含有126和127个质子
Bi分别含有126和127个质子
答案:B
解析:难度,易,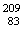 Bi和
Bi和 Bi互为同位素,质子数相同,电子数同,中子数不同。
Bi互为同位素,质子数相同,电子数同,中子数不同。
1.(07年宁夏理综·9)下列叙述错误的是
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
答案:D
解析:同位素是指质子数相同而中子数(或质量数)不同的统一元素的不同核素之间的称谓,故A选项是正确的;1H和2H是同一元素的不同核素,它们的质子数均为1,因此B选项正确;14C的中子数为14-6=8,而14N的中子数为14-7=7,故C选项正确;6Li和7Li互为同位素,它们的中子数不同分别为3和4,因此D选项错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com