
12.(07年宁夏理综·31B)[化学-选修物质结构与性质]
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 型,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
答案:(1)1s22s22p63s23p6 (2)HCl H2S V
极性 (3)H2O2 2H2O2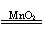
 2H2O+O2↑(4)CH4O
2H2O+O2↑(4)CH4O
解析:(1)因A有18个电子且只有1个原子,所以A为18号元素Ar,按照核外电子排布规律可以写出其电子排布式为1s22s22p63s23p6 。
(2)B、C两分子均有2种元素组成的,是分别含有2和3个原子的18电子的分子,所以B为HCl,C为H2S,H2S的结构与水分子的结构相似均为“V”型的极性分子。
(3)因为D分子中含有4个原子、2种元素、18个电子,且在溶液中加入MnO2后生成无色气体,所以D为H2O2
。反应的化学方程式为2H2O2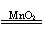
 2H2O+O2↑。
2H2O+O2↑。
(4)因为1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,所以1个E分子中含有1个C原子和4个H原子。又因为E分子中含有6个原子且为18电子分子,因此E中含有的另一个原子为O原子。因此E的化学式为CH4O。
11.(07年广东化学·29)(10分)
C、S、O、Se是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)C、Si、Sa三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-3,CO分子中碳氧键的伸缩振动频率为2143cm-2,则Ni(CO)中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A.强
B.弱
C.相等
D.无法判断
答案:(10分)
(1)1s22s22p63s23p63d104s24p2
(2)Sn
(3)①直线型 共价键(或α键与π键)②Si=O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构共价键(或α键)③熔融时能导电、较高的熔点
(4)配位键
(5)B
解析:考查学生对原子结构和原子核外电子排布的了解,对常见物质空间构型和化学键与物质性质的了解,以及对原子晶体、金属晶体、简单配合物的结构的了解和对离子键形成的理解,考查学生的归纳推理能力、信息迁移能力及其综合应用能力。
10.(11分)(2007海南·25)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
答案:(1)N(2)Cl K(3)Fe 1s22s22p63s23p63d64s2
(4) Cu 1s22s22p63s23p63d104s1
考点:本题考查了常见元素种类推断以及原子结构。
解析:(1)A元素原子核外共有5个电子,则核内为5个质子,因此为N。(2)B、C分别为17、19号元素即Cl、K。(3)D3+的电子排布式为1s22s22p63s23p63d5,可知D为26号元素,即Fe,因此其基态原子的电子排布式为1s22s22p63s23p63d64s2。(4)E元素原子核外共有29个电子,即第29号元素为Cu,电子排布式为1s22s22p63s23p63d104s1。
9. (09年海南化学·19.3)下列说法中错误的是:
(09年海南化学·19.3)下列说法中错误的是:
 A.SO2、SO3都是极性分子
A.SO2、SO3都是极性分子
 B.在NH4+
和[Cu(NH3)4]2+中都存在配位键
B.在NH4+
和[Cu(NH3)4]2+中都存在配位键
 C.元素电负性越大的原子,吸引电子的能力越强
C.元素电负性越大的原子,吸引电子的能力越强
 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
答案:A
解析:A选项中,SO3是平面三角形的分子,为非极性分子,明显错误。
8. (09年海南化学·19.2)下列有关物质性质、结构的表述均正确,且存在因果关系的是:
(09年海南化学·19.2)下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
答案:B
解析:A选项中,NaCl溶于水是离子晶体的特性,I2是非极性分子溶解度小;B选项中分子的稳定性与键能有关,所以正确;C中形成化合物不一定是最高价或最低价,所以不与最外层电子数呈因果关系;D选项因P4O10发生了反应,所以不能证明P4O10是共价化合物。
7.
 (09年海南化学·19.1)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
(09年海南化学·19.1)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
 A.Li,F B.Na,F C.Na,C1 D.Mg,O
A.Li,F B.Na,F C.Na,C1 D.Mg,O
答案:B
解析:比较两原子电负性的差,其中Na与F的电负性差最大。
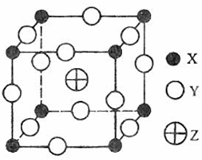
6.(08年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的A
A.ZXY3 B.ZX2Y6
C.ZX4Y8 D.ZX8Y12
答案:A
解析:化合物的化学式确定的方法为均摊法。X处在正方体的八个顶点上,其个数为: ;Y处在正方体的12条楞上,其个数为:
;Y处在正方体的12条楞上,其个数为: ;Z处在正方体的体心上,其个数为1。
;Z处在正方体的体心上,其个数为1。
5.(08年海南化学·23)在基态多电子原子中,关于核外电子能量的叙述错误的是C
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
 C.p轨道电子能量一定高于s轨道电子能量
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
答案:C
解析:选项C没有指明p轨道电子和s轨道电子是否处于同一电子层。
4.(08年海南化学·22)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
答案:C
解析:由于石墨的结构是平面六边形,每个碳原子以sp2杂化轨道的类型形成的三个共价键是正三角形构型,而硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。因此B原子杂化轨道的类型为sp2类型,且羟基之间作用力为氢键。
3.(2007海南·24)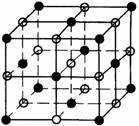 NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl
NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl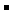 离子的数目分别是( )
离子的数目分别是( )
A.14,13 B.1,1 C.4,4 D.6,6
答案:C
考点:本题考查了NaCl晶胞的结构。
解析:每个NaCl晶胞中含有的Na+离子和Cl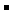 离子的数目分别是4、4。
离子的数目分别是4、4。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com