
6.(08年宁夏理综·10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
答案:C
解析:甲醇与氧气反应的化学方程式为:2CH3OH+3O2 2CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
2CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
5.(07年广东化学·20)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
答案:CD
解析:电解时阳极产生Cl2,电极反应为2Cl--2e-=Cl2,,故C对,阳极不可能是活泼性电极如铁,故A错。阳极产生Cl2与碱反应,故pH值降低,故B错,二价镍全部转化为三价镍失e-,故D对。
4.(07年广东理基·25)钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 2Fe2++4OH-。以下说法正确的是
A.负极发生的反应为:Fe-2e- Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
答案:A
解析:钢铁在潮湿的环境中发生吸氧腐蚀,负极反应为:Fe-2e- Fe2+,正极反应为:2H2O+O2+4e- 4OH-,在空气与水交界处溶液中的氧气不断溶解,因此在空气与水交界处钢铁更容易腐蚀。
3.(07年广东文基·62)下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
答案:B
解析:需要加热的化学反应也可能是放热反应,如可燃物的燃烧反应,A选项错误;原电池是将化学能转化为电能的装置,故C选项错误;水力发电是将机械能转化为电能的过程,故D选项错误。正确选项为B
2.(07年广东化学·12)为了避免青铜器生成铜绿,以下方法正确的是
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
答案:BD
解析:铜绿是生活中常见现象,反应原理为2Cu+O2+CO2+H2O==Cu2CO3(OH)2,故青铜器应保存在干燥的环境中或表面覆盖一层防渗的高分子膜防止被腐蚀。A可能发生原电池反应而被腐蚀。
1.(07年广东化学·9)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2=2H++2e-
D.O2+2H2O+4e-=4OH-
答案:C
解析:难度:易,电解液为酸性,故A错,负极通入氢气,正极通入氧气,故B、D错。
25.(09年山东理综·32)(8分)(化学-物质物质性质)
G和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO:中Si与O原子间不形成上述π健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健 。
答案:(1)1s22s2sp63s23p2 O>C>Si(2)sp3 共价键(3)Mg Mg2+半径比Ca2+小,MgO的晶格能大(4)C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成较稳定的π键。而Si原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成稳定的π键
 解析:(1)C、Si和O的电负性大小顺序为:O>C>Si。(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3
。(3)SiC电子总数是20个,则氧化物为MgO;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。(4) Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
解析:(1)C、Si和O的电负性大小顺序为:O>C>Si。(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3
。(3)SiC电子总数是20个,则氧化物为MgO;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。(4) Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
 [考点分析]物质结构与性质、原子结构、杂化方式综合考查
[考点分析]物质结构与性质、原子结构、杂化方式综合考查
24.(09年宁夏理综·38)[化学-选修物质结构与性质](15分)
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为 ,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是 ;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由 。
答案:(1)1s22s22p63s23p63d104s24p3 As(2) (3)三角锥
(3)三角锥
(4)As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O (5)稳定性:NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定 沸点:NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高。
解析:(1)X元素原子的4p轨道上有3个未成对电子,可通过写电子排布式得到X为33号元素As;(2)Y元素原子的最外层2p轨道上有2个未成对电子,同样根据电子排布式得到Y为O;再根据X、Y和Z三种元素的原子序数之和等于42可得到Z为H.(3)-(5)就不再分析了。
[点评]涉及电子排布的问题,一般相对简单,这也是目前选修科目的一个趋势。
23. (09年江苏化学·21A)(12分)
(09年江苏化学·21A)(12分) 生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
 (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式
。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式
。
 (2)根据等电子原理,写出CO分子结构式
。
(2)根据等电子原理,写出CO分子结构式
。
 (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
 ①甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
。
①甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
。
 ②甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为 。
②甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为 。
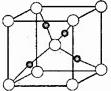
 ③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为
。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为
。
 答案:(1)1s22s22p63s23p63d104s2[Ar]3d104s2
答案:(1)1s22s22p63s23p63d104s2[Ar]3d104s2
 (2)C
(2)C
 O(或C
O(或C
 O)
O)
 (3)①甲醇分子之间形成氢键 sp2杂化
(3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA
②平面三角形 3NA ③4
③4
 解析:(1)Zn的原子序数为30,注意3d轨道写在4s轨道的前面;(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:互为等电子体分子的结构相似,可写出CO的结构式;(3)甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;甲醛分子中含有碳氧双键,故碳原子轨道的杂化类型为sp2杂化;分子的空间构型为平面型;1mol甲醛分子中含有2mol碳氢σ键,1mol碳氧σ键,故含有σ键的数目为 3NA;依据晶胞示意图可以看出Cu原子处于晶胞内部,所包含的Cu原子数目为4。
解析:(1)Zn的原子序数为30,注意3d轨道写在4s轨道的前面;(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:互为等电子体分子的结构相似,可写出CO的结构式;(3)甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;甲醛分子中含有碳氧双键,故碳原子轨道的杂化类型为sp2杂化;分子的空间构型为平面型;1mol甲醛分子中含有2mol碳氢σ键,1mol碳氧σ键,故含有σ键的数目为 3NA;依据晶胞示意图可以看出Cu原子处于晶胞内部,所包含的Cu原子数目为4。
 [考点分析]本题主要考查核外电子排布式、等电子体原理、分子间作用力、杂化轨道、共价键类型、分子的平面构型。
[考点分析]本题主要考查核外电子排布式、等电子体原理、分子间作用力、杂化轨道、共价键类型、分子的平面构型。
22.(09年广东化学·27)(10分)
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为 。
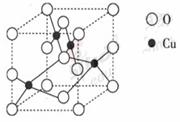
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
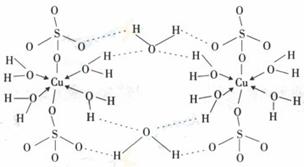
下列说法正确的是 (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH2)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
答案:(1)1s22s22p63s23p63d9(2)4(3)ACD(4)NF3分子中氟原子非金属性强是吸电子的,使得氮原子上的孤对电子难于与Cu2+形成配位键(5)高;由于氧离子的例子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高。
解析:(1)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,失去两个电子后电子排布式应为1s22s22p63s23p63d9。
(2)由题给图示可以看出氧原子O有8个位于定点,2个位于面心,4个位于棱上,1个位于体内,所以晶胞中氧离子个数为8×1/8+2×1/2+4×1/4+1=4。
(3)在上述结构示意图中,所有氧原子都是饱和氧原子,所以都采用sp3杂化,A正确;在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,B正确;
胆矾是五水硫酸铜,从性质和组成上应为离子晶体,C错误;由于胆矾晶体中水两类,一类
是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,D正确。答案:ACD。
(4)NF3分子中氟原子非金属性强是吸电子的,使得氮原子上的孤对电子难于与Cu2+形成配位键。
(5)Cu2O和Cu2S均为离子化合物,离子化合物的熔点与离子键的强弱有关。由于氧离子的例子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com