
22.(09年宁夏理综·11)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
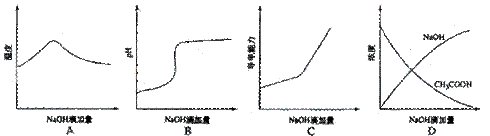
答案:D
解析:A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低。B选项醋酸中滴加氢氧化钠酸性减弱pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,因此氢氧化钠开始时为0.
[点评]本题考查水溶液中的离子反应的相关知识,题目容量大,对考生的能力要求很高。
18.(09年广东理基·33)下列说法正确的是
A.向0.1mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3-、Cl-、CO32-、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D. 分别于等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同
答案:A
解析:Na2CO3溶液中存在CO32-的水解CO32-+H2O HCO3-+OH-,使溶液显碱性,因此加入酚酞后溶液变为红色,故A选项正确。B选项中pH=2的溶液显酸性,弱酸跟阴离子CO32-不能存在;C选项中的乙醇不是电解质,只有乙酸是电解质;HCl是一元酸而H2SO4是二元酸,因此等物质的量的HCl和H2SO4消耗的NaOH的物质的量之比为1︰2。
HCO3-+OH-,使溶液显碱性,因此加入酚酞后溶液变为红色,故A选项正确。B选项中pH=2的溶液显酸性,弱酸跟阴离子CO32-不能存在;C选项中的乙醇不是电解质,只有乙酸是电解质;HCl是一元酸而H2SO4是二元酸,因此等物质的量的HCl和H2SO4消耗的NaOH的物质的量之比为1︰2。
19 .(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
.(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
 A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
 B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.MgO的熔点很高,可用于制作耐高温材料
C.MgO的熔点很高,可用于制作耐高温材料
 D.电解MgCl2饱和溶液,可制得金属镁
D.电解MgCl2饱和溶液,可制得金属镁
 答案:D
答案:D
 解析:A项,明矾净水的原理是Al3++3H2O
解析:A项,明矾净水的原理是Al3++3H2O Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O
Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融)
Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
 [考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
[考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
 20
20 .(09年江苏化学·9)下列化学实验事实及其解释都正确的是
.(09年江苏化学·9)下列化学实验事实及其解释都正确的是
 A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
 B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
 C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
 D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1
AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp
D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1
AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp
 答案:AD
答案:AD
 解析:A项,是高中化学必修1一个很重要的实验---萃取实验;B项的叙述是错误的,在该实验中根本得不到白色沉淀,因为亚硫酸不可能制取盐酸;C项只能说明Fe2+具有还原性,因为KMnO4具有强氧化性,常做氧化剂。D项,沉淀呈黄色,说明沉淀是AgI,也就意味着AgCl的Ksp比AgI的大。
解析:A项,是高中化学必修1一个很重要的实验---萃取实验;B项的叙述是错误的,在该实验中根本得不到白色沉淀,因为亚硫酸不可能制取盐酸;C项只能说明Fe2+具有还原性,因为KMnO4具有强氧化性,常做氧化剂。D项,沉淀呈黄色,说明沉淀是AgI,也就意味着AgCl的Ksp比AgI的大。
 [考点分析]
[考点分析]
 ①重要试验的操作过程、实验现象、结论和解释应牢记;
①重要试验的操作过程、实验现象、结论和解释应牢记;
 ②Ksp的运用。
②Ksp的运用。
 21
21 .(09年江苏化学·13)下列溶液中微粒的物质的量浓度关系正确的是
.(09年江苏化学·13)下列溶液中微粒的物质的量浓度关系正确的是
 A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
 B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
 C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
 D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
 答案:AC
答案:AC
 解析:B项,NaHCO3溶液中,OH-是由HCO3- 水解和水的电离所出成的,但是这些都是微弱的。HCO3- 的浓度永大于OH-浓度,故错;D项,由电荷守恒有:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ,由物料守恒可得:2c(Na+)= c(CH3COO-)+ c(CH3COOH),将两式中的c(Na+) 消去,可得c(CH3COO-)+2c(OH-)=2c(H+)+ c(CH3COOH)。所以c(CH3COO-)+c(OH-)-c(H+)-c(CH3COOH)= c(H+)-c(OH-),因为pH=4.75,故c(H+)-c(OH-)>0,所以D项不等式应为”>”
,故错。
解析:B项,NaHCO3溶液中,OH-是由HCO3- 水解和水的电离所出成的,但是这些都是微弱的。HCO3- 的浓度永大于OH-浓度,故错;D项,由电荷守恒有:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ,由物料守恒可得:2c(Na+)= c(CH3COO-)+ c(CH3COOH),将两式中的c(Na+) 消去,可得c(CH3COO-)+2c(OH-)=2c(H+)+ c(CH3COOH)。所以c(CH3COO-)+c(OH-)-c(H+)-c(CH3COOH)= c(H+)-c(OH-),因为pH=4.75,故c(H+)-c(OH-)>0,所以D项不等式应为”>”
,故错。
 [考点分析]
[考点分析]
 ①混合溶液中离子浓度的关系,电荷守恒。
①混合溶液中离子浓度的关系,电荷守恒。
 ②等pH的溶液中物质的量浓度的大小关系
②等pH的溶液中物质的量浓度的大小关系
 ③电离和水解的相互关系
③电离和水解的相互关系
 ④酸式盐溶液中离子的浓度大小关系
④酸式盐溶液中离子的浓度大小关系
17.(09年广东理基·27)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法
|
选项 |
污染物 |
处理措施 |
方法类别 |
|
A |
废酸 |
加生石灰中和 |
物理法 |
|
B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
|
C |
含苯废水 |
用活性炭吸附 |
物理法 |
|
D |
含纯碱的废水 |
加石灰水反应 |
化学法 |
答案:D
解析:A选项废酸中加生石灰中和是化学处理法,错误。B选项中加硫酸盐不能使Cu2+形成沉淀,错误。C选项中用活性炭不能吸附苯,错误。D选项中加石灰水后纯碱会形成CaCO3沉淀而除去,属于化学处理法,正确。
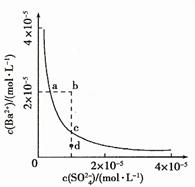
16. (09年广东化学·18)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
(09年广东化学·18)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到263K后变为不饱和溶液
答案:BC
解析:平衡常数只与温度有关,与物质的浓度无关,A错误;温度一定时Ksp=[Sr2+][SO42-],由图可知,313K时,相同SO42-浓度下,Sr2+的浓度最大,所以平衡常数最大,B正确;283K时,Sr2+的浓度比平衡时要小,Qc小于Ksp(283K),对应为不饱和溶液,C正确;283K下的饱和溶液,突然升温至363K,Ksp减少,析出沉淀,仍然为饱和溶液,D错误。
15.(09年广东化学·16)磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
A.H3PW12O40在该酯化反应中其催化作用
B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8
答案:CD
解析:因浓硫酸在制备乙酸乙酯中起到催化剂和吸水剂的作用,又杂多酸可代替浓硫酸制备乙酸乙酯,所以杂多酸同样起到催化作用,A正确;因大多数盐属于强电解质,所以杂多酸盐为强电解质,所以杂多酸盐也为强电解质,B正确;磷钨酸又可将其视作为H3PO4与WO3的混合酸,因磷酸为三元中强酸,磷酸盐中含有的酸根不同即原子团不同,C错误;从化合价和代数为0可知W的价态为+6价,D错误。
14.(09年广东化学·9)下列浓度关系正确的是
A.氯水中:c(Cl2)=2c(ClO-)+c(Cl-)+C(HCl)}
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
答案:D
解析:氯气在水中与水反应是可逆反应,物料守恒不成立,A错误;Cl2+H2O=HCl+HClO,HCl中电离的H+与Cl-浓度相等,再加上HClO会电离出H+,所以H+浓度一定大于Cl-浓度,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好完全反应生成醋酸钠,因CH3COO-水解,所以Na+浓度大于CH3COO-的浓度,C错误。
13. (09年福建理综·10)在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O
(09年福建理综·10)在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
 A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
 C.升高温度,
C.升高温度, 减小 D.加入NaOH固体,溶液pH减小
减小 D.加入NaOH固体,溶液pH减小
答案:B
解析:平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
11.(08年山东理综·15)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是C
提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
答案:C
解析:A项,当加入Na2SO4溶液时,c(SO42-)增大,因Ksp为常数,则c(Ba2+)就会减小,故A错;B项,蒸发可以会使溶液的c(SO42-)和c(Ba2+)都变大,故B错;C项,在d点时,因其在沉淀溶解平衡点c点的下方,c(Ba2+)较小,故它们浓度的乘积小于Ksp,则无无BaSO4沉淀生成,C正确;D项,因ac两点对应的都是在相同的温度下的Ksp,故二者的Ksp相同,D错。
 12
12 .(09年安徽理综·13)向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
.(09年安徽理综·13)向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
 A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
 B.Va=Vb时:c (CH3COOH) +c (H+)>c
(OH-)
B.Va=Vb时:c (CH3COOH) +c (H+)>c
(OH-)
 C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
 D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
 答案:C
答案:C
 解析:若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
解析:若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
10.(08年江苏化学·12)下列溶液中有关物质的量浓度关系正确的是AC
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
答案:A、C
 解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH-)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa);选项C中根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于c(CH3COOH)=c(CH3COONa),且它们等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,将①×2-②得:c(CH3COO-)
+2c(OH-)
== 2c(H+)
+ c(CH3COOH);选项D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(A2-)>c(H+)>c(H2A)。
解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH-)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa);选项C中根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于c(CH3COOH)=c(CH3COONa),且它们等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,将①×2-②得:c(CH3COO-)
+2c(OH-)
== 2c(H+)
+ c(CH3COOH);选项D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(A2-)>c(H+)>c(H2A)。
9.(08年海南化学·9)下列离子方程式中,属于水解反应的是C
A.HCOOH+H2O HCOO-
+ H3O+
HCOO-
+ H3O+
B.CO2+H2O HCO3-
+ H+
HCO3-
+ H+
C.CO32-
+ H2O HCO3- + OH-
HCO3- + OH-
D.HS- +
H2O S2-
+ H3O+
S2-
+ H3O+
答案:C
解析:选项A、B、D表示的都是电离。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com