
2.(07年广东化学·10)下列实验操作完全正确的是
|
编号 |
实验 |
操作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口入出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
答案:C
解析:此题考查化学实验基本操作规范性。A要吸干表面的煤油再切,B中容量瓶不能配制溶液,D中分液时下层液体从下口放出,上层液体从上口倒出。
1.(07年宁夏理综·12) a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
答案:B
解析:根据题意可以知道,铁粉完全反应且反应前后固体的质量不变,因此设参加反应的CuSO4与H2SO4的物质的量分别为x和y,则:
Fe + CuSO4 = FeSO4+Cu △m
1mol 56g
x 56 x g·mol-1
Fe + H2SO4 = FeSO4+H2↑ △m
1mol 8g
y 8 y g·mol-1
因反应前后固体的质量没有发生变化,因此第一个反应质量的减小等于第二个反应质量的增加,即56x g·mol-1=8 y g·mol-1,所以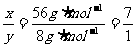 。
。
21.(09年宁夏理综·12)能正确表示下列反应的例子方程式是
A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
答案:D
解析:A选项CO2过量的话,应该生成HCO3- 方程式应为:ClO-+CO2+H2O=HClO+HCO3-;B选项HClO可将CaSO3氧化为CaSO4 ,正确的方程式为:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ ;C选项要考虑到Mg(OH)2 为沉淀即可, Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O。
[点评]本题考查离子方程式的书写和正误判断,把平时练习中的次氯酸钙与CO2和SO2 反应问题在一个题目中出现,很是少见,四个选项都很常规,都是熟题。难度不大。
22 .(09年海南化学·9)在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
.(09年海南化学·9)在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
 A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
 C.CO2、C12、CaO、SO3 D.SiO2、N2O5、CO、C12
C.CO2、C12、CaO、SO3 D.SiO2、N2O5、CO、C12
答案:B
解析:题中的关键词“过量NaOH溶液”,A中只能生成4种盐;B生成5种(NaCl、NaClO、NaAlO2、NaNO3、Na2SO4);C中CaO不能生成盐;D中CO不能成盐。
18.(09年广东理基·33)下列说法正确的是
A.向0.1mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3-、Cl-、CO32-、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D. 分别于等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同
答案:A
解析:Na2CO3溶液中存在CO32-的水解CO32-+H2O HCO3-+OH-,使溶液显碱性,因此加入酚酞后溶液变为红色,故A选项正确。B选项中pH=2的溶液显酸性,弱酸跟阴离子CO32-不能存在;C选项中的乙醇不是电解质,只有乙酸是电解质;HCl是一元酸而H2SO4是二元酸,因此等物质的量的HCl和H2SO4消耗的NaOH的物质的量之比为1︰2。
HCO3-+OH-,使溶液显碱性,因此加入酚酞后溶液变为红色,故A选项正确。B选项中pH=2的溶液显酸性,弱酸跟阴离子CO32-不能存在;C选项中的乙醇不是电解质,只有乙酸是电解质;HCl是一元酸而H2SO4是二元酸,因此等物质的量的HCl和H2SO4消耗的NaOH的物质的量之比为1︰2。
19 .(09年江苏化学·7)在下列各溶液中,离子一定能大量共存的是
.(09年江苏化学·7)在下列各溶液中,离子一定能大量共存的是
 A.强碱性溶液中:K+、Al3+、Cl-、SO42-
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
 B.含有0.1 mol·L-1
Fe3+的溶液中:K+、Mg2+、I-、NO3-
B.含有0.1 mol·L-1
Fe3+的溶液中:K+、Mg2+、I-、NO3-
 C.含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、CO32-、Cl-
C.含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、CO32-、Cl-
 D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
 答案:D
答案:D
 解析:A项,强碱性溶液意味着存在大量的OH-,所以Al3+不能共存(Al3++3OH-=Al(OH)3↓);B项,Fe3+和I-因发生氧化还原反应而不能共存(2Fe3++2I-=2Fe2++I2);C项,Ca2+和CO32-因发生复分解反应而不能共存
解析:A项,强碱性溶液意味着存在大量的OH-,所以Al3+不能共存(Al3++3OH-=Al(OH)3↓);B项,Fe3+和I-因发生氧化还原反应而不能共存(2Fe3++2I-=2Fe2++I2);C项,Ca2+和CO32-因发生复分解反应而不能共存
 [考点分析]离子共存问题(一色、二性、三特殊、四反应牢记)
[考点分析]离子共存问题(一色、二性、三特殊、四反应牢记)
 ①由于发生复分解反应,离子不能大量共存;
①由于发生复分解反应,离子不能大量共存;
 ②由于发生氧化还原反应,离子不能大量共存;
②由于发生氧化还原反应,离子不能大量共存;
 ③溶液酸碱性的判断(隐含条件)。
③溶液酸碱性的判断(隐含条件)。
20 .(09年江苏化学·11)下列离子方程式与所述事实相符且正确的是
.(09年江苏化学·11)下列离子方程式与所述事实相符且正确的是
 A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
 B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
 C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
 D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
 答案:C
答案:C
 解析:漂白粉失效的化学方程式为Ca(ClO)2+H2O+CO2=CaCO3+2HClO,那么该反应的离子方程式是Ca2++2ClO-+H2O+CO2=CaCO3+2HClO,A项错;实验室制取Cl2的原理是浓盐酸和二氧化锰反应,离子方程式为MnO2+4H++2Cl-
解析:漂白粉失效的化学方程式为Ca(ClO)2+H2O+CO2=CaCO3+2HClO,那么该反应的离子方程式是Ca2++2ClO-+H2O+CO2=CaCO3+2HClO,A项错;实验室制取Cl2的原理是浓盐酸和二氧化锰反应,离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,所以B项错;D项,在强碱溶液中,不可能生成H+,所以D错。
Mn2++Cl2↑+2H2O,所以B项错;D项,在强碱溶液中,不可能生成H+,所以D错。
 [考点分析]离子方程式的正确书写
[考点分析]离子方程式的正确书写
17.(09年广东理基·32)下列离子方程式正确的是
A.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑
B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C.氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓
D. CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓
答案:D
解析:金属与稀硝酸反应不会生成氢气,硝酸具有强氧化性将生成NO气体,A选项错误。小苏打与氢氧化钠溶液混合后发生的反应为HCO3-+OH-=CO32-+H2O,不会生成CO2气体,故B选项错误。氯化钙与碳酸氢钾不反应,C选项错误。
16.(09年广东化学·12)下列离子方程式正确的是
A.向盐酸中滴加氨水:H++OH-=H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
答案:C
解析:氨水是弱电解质,应写分子形式,A错误。漏写Fe3+与I-的氧化还原反应, B错误;SO32-亚硫酸根可被Cl2氧化(氯气足量),D错误。
14.(08年江苏化学·10)下列离子方程式正确的是BD
A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+
 H2↑+ Cl2↑
H2↑+ Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+
+ 2OH- CH3COO- + NH4+
+3NH3 + 3Ag↓+ H2O
CH3COO- + NH4+
+3NH3 + 3Ag↓+ H2O
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH
+ 2CO32-
2C6H5OH
+ 2CO32-
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- == 5SO42- + 2Mn2+ 3H2O
答案:B、D
解析:选项A中水为弱电解质,书写离子方程式时不能改写;选项C中正确的离子方程式为:
 -O-+CO2+H2O
-O-+CO2+H2O
 -OH+HCO3-。
-OH+HCO3-。
15 .(09年安徽理综·10)在溶液中能大量共存的一组离子或分子是
.(09年安徽理综·10)在溶液中能大量共存的一组离子或分子是
 A.NH4+、H+、NO3-、HCO3-
A.NH4+、H+、NO3-、HCO3-
 B.K+
、Al3+、SO42- 、NH3·H2O
B.K+
、Al3+、SO42- 、NH3·H2O
 C.Na+、K+、SO32-、Cl2
C.Na+、K+、SO32-、Cl2
 D.Na+
、CH3COO-、CO32-、OH-
D.Na+
、CH3COO-、CO32-、OH-
 答案:D
答案:D
 解析:A项中H+与HCO3-能够反应生成CO2气体,不能大量共存,错误;Al3+与氨水可以发生反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,B选项错误;Cl2具有氧化性,可以将SO32-氧化为SO42-,方程式为:Cl2+H2O+SO32-=SO42-+Cl-+2H+,C选项错误。
解析:A项中H+与HCO3-能够反应生成CO2气体,不能大量共存,错误;Al3+与氨水可以发生反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,B选项错误;Cl2具有氧化性,可以将SO32-氧化为SO42-,方程式为:Cl2+H2O+SO32-=SO42-+Cl-+2H+,C选项错误。
13.(08年江苏化学·8)在下列溶液中,各组离子一定能够大量共存的是C
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
答案:C
解析:选项A中使酚酞溶液呈红色,则溶液必定呈碱性,则OH-与Fe3+不能共存;选项B中使紫色的石蕊试液变红的溶液呈酸性,NO3-在酸性溶液中具有强氧化性与Fe2+不能共存;选项C中c(H+)=10-12 mol·L-1的溶液呈碱性,在碱性溶液中,这些离子均能共存;选项D中HCO3-与H+不能共存。
12.(08年江苏化学·2)下列文字表述与反应方程式对应且正确的是D
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯: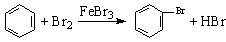
答案:D
解析:选项A中要检验溴乙烷中的溴原子,必须先将溴乙烷在NaOH溶液中水解,然后用过量的HNO3综合NaOH溶液,再加入AgNO3。选项B中CH3COOH为弱酸,在离子方程式中不能改写;选项C中离子方程式的得失电子不守恒和电荷不守恒。
11.(08年海南化学·12)在pH=13的无色溶液中,可以大量共存的一组离子是C
A.NH4+、NO3- 、K+、SO42- B.CO32-、NO3-、HCO3-、Na+
C.Na+、ClO-、AlO2-、NO3- D.CrO42-、K+、Na+、SO42-
答案:C
解析:pH=13,溶液中的c(OH-)=0.1mol·L-1,选项A中NH4+与OH-不能共存;选项B中HCO3-与OH-不能共存;选项D中CrO42-为黄色。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com