
22.(09年广东理基·25)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
答案:A
解析:反应①2Fe+O2+2H2O=2Fe(OH)2中的氧化剂是O2,1molO2在反应中得到4mol电子,同样在反应②4Fe(OH)2+O2+2H2O=4Fe(OH)3中氧化剂也是O2,而且两个反应中氧气的系数都是1,因此得到的电子均是4mol,故A选项正确B选项错误。钢质水管与铜质水龙头连接后形成原电池,其中钢质水管做负极被腐蚀,故C选项错误。钢铁在潮湿的空气中容易发生电化学腐蚀,而且主要是发生吸氧腐蚀,因此D选项错误。
 23
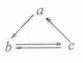
23 .(09年江苏化学·3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
.(09年江苏化学·3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
|
|
a |
b |
 c c |
|
A |
Al |
AlCl3 |
Al(OH)3 |
|
B |
HNO3 |
NO |
NO2 |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
答案:B
 解析:A项:Al→AlCl3
(2Al+6HCl=2AlCl3+3H2↑或者2Al+3H2SO4=Al2(SO4)3+3H2↑,AlCl3→Al(OH)3
(AlCl3+3NH3·H2O=Al(OH)3↓+3NHCl),Al(OH)3→AlCl3(Al(OH)3+3HCl=AlCl3+3H2O),Al(OH)3→Al的转化必须经过Al(OH)3→Al2O3(反应方程式为:2Al(OH)3
解析:A项:Al→AlCl3
(2Al+6HCl=2AlCl3+3H2↑或者2Al+3H2SO4=Al2(SO4)3+3H2↑,AlCl3→Al(OH)3
(AlCl3+3NH3·H2O=Al(OH)3↓+3NHCl),Al(OH)3→AlCl3(Al(OH)3+3HCl=AlCl3+3H2O),Al(OH)3→Al的转化必须经过Al(OH)3→Al2O3(反应方程式为:2Al(OH)3 Al2O3+3H2O)和Al2O3→Al(2Al2O3
Al2O3+3H2O)和Al2O3→Al(2Al2O3 4Al+3O2)这两步,所以A项不选;
4Al+3O2)这两步,所以A项不选;
 B项:HNO3→NO
(8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O),NO→NO2(2NO+O2=2NO2),NO2→NO(3NO2+H2O=2HNO3+NO),NO2→HNO3(3NO2+H2O=2HNO3+NO),所以B项正确;
B项:HNO3→NO
(8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O),NO→NO2(2NO+O2=2NO2),NO2→NO(3NO2+H2O=2HNO3+NO),NO2→HNO3(3NO2+H2O=2HNO3+NO),所以B项正确;
 C项:Si→SiO2(Si+O2=SiO2),SiO2→H2SiO3必须经过两步(SiO2+2NaOH=Na2SiO3+H2O和Na2SiO3+H2O+CO2=H2SiO+Na2CO3),
C项:Si→SiO2(Si+O2=SiO2),SiO2→H2SiO3必须经过两步(SiO2+2NaOH=Na2SiO3+H2O和Na2SiO3+H2O+CO2=H2SiO+Na2CO3),
 D项:CH2=CH2→CH3CH2OH(CH2=CH2+H2O
D项:CH2=CH2→CH3CH2OH(CH2=CH2+H2O CH3CH2OH),CH3CH2OH→CH3CHO(2CH3CH2OH+O2
CH3CH2OH),CH3CH2OH→CH3CHO(2CH3CH2OH+O2 2CH3CHO+2H2O),CH3CHO→CH3CH2OH(CH3CHOH+H2=CH3CH2OH),CH3CHOHCH2=CH2就必须经过两步(CH3CHO+H2
2CH3CHO+2H2O),CH3CHO→CH3CH2OH(CH3CHOH+H2=CH3CH2OH),CH3CHOHCH2=CH2就必须经过两步(CH3CHO+H2 CH3CH2OH和CH3CH2OH
CH3CH2OH和CH3CH2OH CH2=CH2↑+H2O)
CH2=CH2↑+H2O)
 [考点分析]熟练掌握元素及其化合物之间的转化关系
[考点分析]熟练掌握元素及其化合物之间的转化关系
24 .(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
.(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
 A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
 B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.MgO的熔点很高,可用于制作耐高温材料
C.MgO的熔点很高,可用于制作耐高温材料
 D.电解MgCl2饱和溶液,可制得金属镁
D.电解MgCl2饱和溶液,可制得金属镁
 答案:D
答案:D
 解析:A项,明矾净水的原理是Al3++3H2O
解析:A项,明矾净水的原理是Al3++3H2O Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O
Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融)
Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
 [考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
[考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
21.(09年广东理基·24)下列除去杂质的方法正确的是
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
答案:C
解析:除去CO2中混有的CO应用点燃的方法,若用澄清石灰水洗气只会吸收主要气体CO2,对杂质没有影响,因此A选项错误。加过量盐酸后会溶解主要成分BaCO3,对杂质没有作用,故B选项错误。C选项中加入过量铁粉后会发生Fe+2FeCl3=3FeCl3反应而除去杂质FeCl3,故C选项正确。D选项中加稀硝酸后,Cu和CuO都会溶解,因此D选项也是错误的。
20.(09年广东理基·23)下列有关金属及其合金的说法不正确的是
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
答案:B
解析:生铁、普通钢和不锈钢中的碳含量是依次降低。
19.(09年广东理基·21)下列实验能达到实验目的且符合安全要求的是
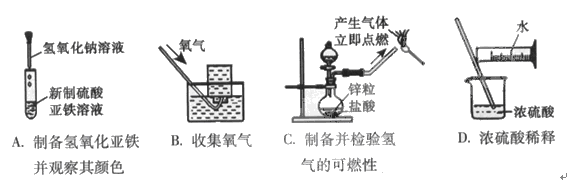
答案:B
解析:制备氢氧化亚铁沉淀时,应将滴管伸入溶液中,以防止在液体滴落的过程中代入氧气氧化氢氧化亚铁,因此A选项错误。氧气难溶于水,可以用排水法收集,因此B选项正确。C选项中产生的气体为可燃性氢气,应验纯后在点燃,以防止爆炸,故C选项错误。稀释浓硫酸时应将浓硫酸注入水中,因此D选项错误。
18.(09年广东化学·10)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
答案:BC
解析:合金的熔点一般比各组分的熔点要低,所以锡铜合金的熔点比纯铜低,A错误;Sn与Cu形成原电池,因Sn比Cu金属活泼性强,所以 Sn作负极,Cu作正极,Sn对Cu起到保护作用,B正确;合金在潮湿环境下,可可以发生电化学腐蚀,比干燥环境腐蚀要快,C正确;电化学腐蚀同样属于化学反应过程,D错误。
17. (09年福建理综·7)能实现下列物质间直接转化的元素是
(09年福建理综·7)能实现下列物质间直接转化的元素是

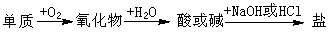
 A.硅 B.硫 C.铜 D.铁
A.硅 B.硫 C.铜 D.铁
答案:B
解析:S与O2生成SO2,再与H2O生成H2SO3,可以与NaOH生成Na2SO3,B项正确。A项,SiO2不与水反应,错;C项中CuO,D项中Fe3O4均不与H2O反应,故错。
16.(08年江苏化学·13)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是B
A.密闭容器中CuO和C高温反应的气体产物: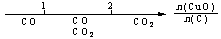
B.Fe在Cl2中的燃烧产物: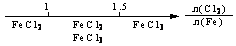
C.AlCl3溶液中滴加NaOH后铝的存在形式: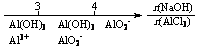
D.氨水与SO2反应后溶液中的铵盐: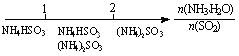
答案:B
解析:Fe在Cl2中燃烧的产物与Fe和Cl2的用量无关,其产物只有FeCl3。
15.(08年广东文基·64)铁和铁合金是生活中常用的材料,下列说法正确的是B
A.不锈钢是铁合金,只含金属元素
B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
答案:A
解析:本题考查了常见金属铁及其合金,金属腐蚀的有关知识。铁是一种较活波的金属单质,在高温的条件下可以与水蒸气反应,A为正确选项,不锈钢是由普通钢中加入铬、镍等多种元素炼成的钢材,里面含有C元素,B是错项。C项铁在氢的前面,能与盐酸反应,铁合金主要成分是铁,能与盐酸反应,是错项,很多同学误选这项,只看了前面的内容,后面不看。金属的腐蚀与金属的活波性有关,越活波,越易被腐蚀,因此D为错项。
14.(08年广东理基·34)根据陈述的知识,类推得出的结论正确的是
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可以使其褪色
C.CO2和SiO2 化学式相似,则CO2与SiO2的物理性质也相似
D.金刚石的硬度大,则C60的硬度也大
答案: B
解析: A. 钠在空气中燃烧生成Na2O2而非Na2O;
B. 具有重键的有机物和苯的同系物都可以使高锰酸钾溶液褪色;
C. CO2在常温下是气态,为分子晶体,低熔沸点;而SiO2在常温下是固态,为原
子晶体,高熔沸点;
D. C60是分子晶体,硬度小;而金刚石是原子晶体,硬度大。
13.(08年广东化学·12)下列有关金属腐蚀与防护的说法正确的是AC
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
答案:AC
解析:银器在空气中久置会被O2所氧化变黑,为化学腐蚀,A正确。当镀层破损时,Sn-Fe可形成原电池,不再起到保护作用,B错。与Zn块形成原电池,Zn作负极(阳极),从而保护Fe正极(阴极),所以C正确;外加电流保护法应该与直流电源的负极相连,故D错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com