
知识准备:近两年计算型推断题成为高考热点之一,解这类题时要善于抓住物质转化时相对分子质量的变化(例CO→CO2,NO → NO2,SO2→SO3转化时分子中都增加1个氧原子,相对分子质量变化均为16 );放出气体的体积或生成沉淀的量;化合物中各元素的含量;气体的相对密度;相对分子质量;离子化合物中离子个数比;反应物之间的物质的量比;电子总数;质子总数等重要数据。
例10. 已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示:
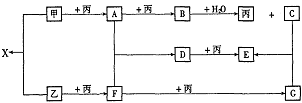
(1)写出X的电子式和G的化学式:X__________,G__________;
(2)写出有关变化的化学方程式:
B+H2O:____________;
D+丙:_____________。
[解析]单质甲、乙均能分别与单质丙连续两次反应,可能是单质甲、乙分别被O2连续两次氧化,生成不同的氧化物,则丙是O2。氧化物B与水反应能放出O2,则B是Na2O2,那么C是NaOH,A是Na2O,甲是Na。又因B和X的摩尔质量相同,则X是Na2S,那么乙是S,F是SO2,G是SO3。进一步推出D是Na2SO3,E是Na2SO4,而Na2SO4的相对分子质量比Na2SO3的相对分子质量大16,符合题意。
[答案](1) Na+[: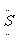 :]2-Na+;SO3(2)2Na2O2+2H2O=4NaOH+O2;2Na2SO3+O2=2Na2SO4
:]2-Na+;SO3(2)2Na2O2+2H2O=4NaOH+O2;2Na2SO3+O2=2Na2SO4
例11. A-J是中学化学教材中常见的物质,A-J有如下转化关系,J是不溶于水的白色固体,且其相对分子质量为100。则(1)A的化学式是____,J的化学式是_____。(2)B和E反应的化学方程式是_______。
解析:J是不溶于水的白色固体,且其相对分子质量为100,可知J是CaCO3。D与K反应生成I和J,可知D与CaCO3含有相同的离子或元素。C能与Na2O2反应生成H,还有和D与K反应相同的产物I,可知C是CO2或H2O,I不可能是O2,H应是O2。因G和H反应生成B,则B可能是一种氧化物。A受热分解生成B、C和D,结合以上对B、C和D的分析,可知A是NaHCO3,则B是CO2,C是H2O,D是Na2CO3。进一步推出E是Mg,F是MgO,G是单质碳,I是NaOH。
答案(1)NaHCO3,CaCO3 (2)2Mg+CO2======2MgO+C
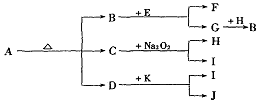
 例12.已知A是一种有机溶剂,F 是一种黄色晶体,N带有磁性,B、F、L、O、P是中学化学常见单质,J的相对分子质量比D大16,A和B反应前后气体体积(常温常压)保持不变,在试管中灼烧固体I,试管底部无固体残留,反应①②③均是化工生产中的重要反应。
例12.已知A是一种有机溶剂,F 是一种黄色晶体,N带有磁性,B、F、L、O、P是中学化学常见单质,J的相对分子质量比D大16,A和B反应前后气体体积(常温常压)保持不变,在试管中灼烧固体I,试管底部无固体残留,反应①②③均是化工生产中的重要反应。
⑴A的结构式___________。
⑵写出反应①的化学方程式_________________________________。
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式_________________________________,该反应的平衡常数表达式K=_______。
⑷请设计一个实验方案,完成反应④,并在答题卡指定位置绘出实验装置图。
⑴ S=C=S;⑵ NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl;⑶ 3Fe+4H2O(g) Fe3O4+4H2 K=
Fe3O4+4H2 K=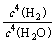 ;⑷
;⑷
 例9. (2009年全国二卷)
例9. (2009年全国二卷)
 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有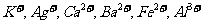 ,
, 阴离子有
阴离子有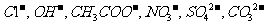 ,现将它们分别配成
,现将它们分别配成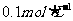 的溶液,进行如下实验:
的溶液,进行如下实验:
① 
 测得溶液A、C、E呈碱性,且碱性为A>E>C;
测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 
 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③ 
 向D溶液中滴加
向D溶液中滴加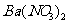 溶液,无明显现象;
溶液,无明显现象;
④ 
 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。

 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1) 
 实验②中反应的化学方程式是
实验②中反应的化学方程式是

 ;
;

 (2)E溶液是 ,判断依据是
(2)E溶液是 ,判断依据是

 ;
;

 (3)写出下列四种化合物的化学式:A
、C
、
(3)写出下列四种化合物的化学式:A
、C
、

 D
、F
.
D
、F
.
 [解析]本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定CO32-只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无SO42-,则F中的阴离子为SO42-,D中的阴离子为Cl-。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。
[解析]本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定CO32-只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无SO42-,则F中的阴离子为SO42-,D中的阴离子为Cl-。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。

 [答案]
[答案]


例6:由短周期元素组成的A、B、C、D、E、F六种粒子,其中只有C、D是分子,其余四种均是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种粒子间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,若加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1)微粒B的电子式是_____________;粒子E的名称是____________;粒子F对应的元素在周期表中的位置是_________________________________。
(2)写出下列反应的离子方程式:
F+过量C的溶液:___________________________________________________
W+含大量B离子的溶液:
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该复盐的浓溶液中滴加浓苛性钠溶液,依次产生的现象有:a.溶液中出现白色沉淀b. 沉淀逐渐增多c. 有刺激性气味气体放出 d. 沉淀逐渐减少 e.沉淀完全消失
该复盐的化学式为 ,在水溶液中的电离方程式是___________。
[解析]由②可知C为NH3,根据A、E是非金属元素组成的阳离子,可知A、E分别是NH4+和H3O+中的一种。由①和③可确定A为NH4+,B为OH-,D为H2O,E为H3O+。白色沉淀W不溶于过量的氨水,却既溶于“酸”又溶于“碱”,那么F离子只能是Al3+
[答案](1)[H]-;水合氢离子;第三周期ⅢA族

 (2)Al3++3NH3·H2O Al(OH)3↓+3NH4+;Al(OH)3+ OH- AlO2-+2H2O
(2)Al3++3NH3·H2O Al(OH)3↓+3NH4+;Al(OH)3+ OH- AlO2-+2H2O
 (3)NH4Al(SO4)2; NH4Al(SO4)2 NH4++Al3++2SO42-
(3)NH4Al(SO4)2; NH4Al(SO4)2 NH4++Al3++2SO42-
 例7.(2009年福建卷)
例7.(2009年福建卷)
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
 (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______.
 (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
 (3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
 (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条
件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的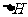 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
[解析]本题考查无机物的性质,涉及化学用语、方程式书写、氧化还原反应以及热化学的知识。从给出的表,结合T在周期表的位置与族数相等这一条件 ,不难得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)S、C最高价氧化物对应的酸为硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO + O2 = 2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。(6)C + O2  CO2 H=
-a Kj/mol①,4Al +3 O2
=2Al2O3 H= -4bKj/mol②。Al与CO2的置换反应,写出反应方程式为:4Al + 3CO2
CO2 H=
-a Kj/mol①,4Al +3 O2
=2Al2O3 H= -4bKj/mol②。Al与CO2的置换反应,写出反应方程式为:4Al + 3CO2 3C + 2Al2O3,此反应的H为可由②-①×3得,H=-4b-(-3a)=(3a-4b)Kj/mol.
3C + 2Al2O3,此反应的H为可由②-①×3得,H=-4b-(-3a)=(3a-4b)Kj/mol.
[答案](1) (2)弱于
(2)弱于
(3)S + 2H2SO4(浓)  3SO2↑+ 2H2O
3SO2↑+ 2H2O
(4)2H2O2 MnO22H2O + O2↑(或其他合理答案)
(5)NaNO2
(6)(3a – 4b)KJ/mol
 例8.(2009年天津卷)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
例8.(2009年天津卷)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
 (4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

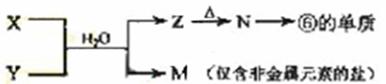
 X溶液与Y溶液反应的离子方程式为_____________________,
X溶液与Y溶液反应的离子方程式为_____________________,
 N→⑥的单质的化学方程式为________________。
N→⑥的单质的化学方程式为________________。
 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
[解析]本题以周期表为题材,考查原子半径比较,酸性强弱,电子式,离子方程式以及盐类水解等知识。(1)⑤⑥位于同一周期,且⑤排在⑥的前面,原子半径大,而④在上一周期,比⑤、⑥少一个电子层,故半径最小。(2)②⑦位于同一主族,上面的非金属性强,最高价含氧酸酸性强,②③位于同一周期,且③在后,非金属性强,对应的酸性强。(3)四种元素分别为氢、氧、钠和氯,离子键显然必须是钠盐,极性共价键则应有两种非金属组成。(4)液态H2O2可以在MnO2、FeCl3等催化剂作用下发生分解反应。(5)⑥为Al,可推断Z为Al(OH)3,受热分解可产物Al2O3,再电解即可得单质铝。M仅含非金属的盐,显然铵盐,所以X与Y应为AlCl3与NH3·H2O的反应,生成NH4Cl。由于NH4+ 水解,故要使其浓度与Cl-相等,则要补充NH3·H2O。由电荷守恒知:C(NH4+ )+ C(H+) C(Cl-)+C(OH-),若C(NH4+ )
C(Cl-)+C(OH-),若C(NH4+ )  C(Cl-),则C(H+)= C(OH-),即pH=7。
C(Cl-),则C(H+)= C(OH-),即pH=7。
 答案:
答案:
例4.下列物质间在一定条件下可实现图中所示的一系列变化。其中固体W的焰色反应呈紫色,A是一切生物都不能缺少的气体。请回答:
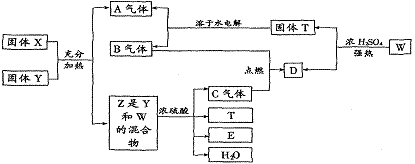
(1)判断X、Y各是什么物质? X_______Y_______。
(2)写出有关反应的化学方程式:
① Z+H2SO4 (浓)→C
② W+H2SO4 (浓)→D+T
[解析]一切生物都不能缺少的气体是O2,固体Y在加热制取O2后未发生变化,则Y是MnO2。焰色反应呈紫色的固体W中含钾元素,来自于固体X,则X是KClO3,W是KCl。气体A和气体B都是固体T的水溶液的电解产物,因A是O2,则B不可能是Cl2,应是H2。KCl和MnO2的混合物与浓H2SO4混合加热,生成的气体C是Cl2,则D是HCl。T和E是MnCl2和K2SO4中的各一种。
[答案](1)KClO3、MnO2
(2)① 4KCl+MnO2+2H2SO4(浓)====Cl2↑+MnCl2+2K2SO4
② 2KCl+H2SO4(浓)====2HCl↑+K2SO4


 例5.(2009年浙江卷)各物质之间的转换关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子量外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,l有漂白作用,反应①常用于制作印刷电路板。
例5.(2009年浙江卷)各物质之间的转换关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子量外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,l有漂白作用,反应①常用于制作印刷电路板。

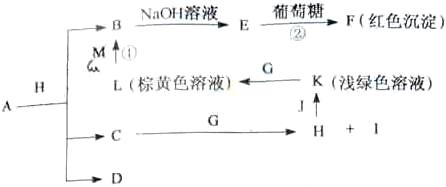

 请回答下列问题:
请回答下列问题:
 (1)写出A的化学式
, C的电子式
。
(1)写出A的化学式
, C的电子式
。
 (2)比较Y与Z的原子半径大小
> (填写元素符号)。
(2)比较Y与Z的原子半径大小
> (填写元素符号)。
 (3)写出反应②的化学方程式(有机物用结构简式表示)
,举出该反应的一个应用实例
。
(3)写出反应②的化学方程式(有机物用结构简式表示)
,举出该反应的一个应用实例
。
 (4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式
。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式
。
 (5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
 [解析]从反应图中寻找突破口,E与葡葡糖生成红色沉淀F,则E应为Cu(OH)2,而B为Cu2+,反应①为印刷电路板,L为棕黄色溶液,由此可推出:M应为Cu,L为FeCl3 。G为黄绿色气体,则为Cl2,K为浅绿色,则为Fe2+溶液。X的原子半径最小,则为H,D为非可燃性气体,可推为CO2,C和O的最外层电子之和刚好为10。C为H、C、O中的两种组成的化合物,且可以与Cl2反应,故应为H2O,生成H为HCl,I为HClO(具有漂白性),HCl与J(Fe)可生成FeCl2溶液。(1)A + HCl
[解析]从反应图中寻找突破口,E与葡葡糖生成红色沉淀F,则E应为Cu(OH)2,而B为Cu2+,反应①为印刷电路板,L为棕黄色溶液,由此可推出:M应为Cu,L为FeCl3 。G为黄绿色气体,则为Cl2,K为浅绿色,则为Fe2+溶液。X的原子半径最小,则为H,D为非可燃性气体,可推为CO2,C和O的最外层电子之和刚好为10。C为H、C、O中的两种组成的化合物,且可以与Cl2反应,故应为H2O,生成H为HCl,I为HClO(具有漂白性),HCl与J(Fe)可生成FeCl2溶液。(1)A + HCl Cu2+ + H2O + CO2,由元素守恒可知,A可以CuCO3或碱式碳酸铜均可。(2)Y为C,Z为N,两者位于同一周期,前者的半径大,即C>N。(3)葡萄糖含有醛基,可以与Cu(OH)2生成砖红色沉淀。(4)F为Cu2O,与HNO3反应,生成Cu(NO3)2,且生成无色气体,应为NO,然后根据得失电子守恒配平即可。(5)CO2可以还原成正四面体结构的晶体N,即化合价降低,显然生成C,应为金刚石。它的同素异形体必须为含碳的单质。
Cu2+ + H2O + CO2,由元素守恒可知,A可以CuCO3或碱式碳酸铜均可。(2)Y为C,Z为N,两者位于同一周期,前者的半径大,即C>N。(3)葡萄糖含有醛基,可以与Cu(OH)2生成砖红色沉淀。(4)F为Cu2O,与HNO3反应,生成Cu(NO3)2,且生成无色气体,应为NO,然后根据得失电子守恒配平即可。(5)CO2可以还原成正四面体结构的晶体N,即化合价降低,显然生成C,应为金刚石。它的同素异形体必须为含碳的单质。
 [答案](1)Cu2(OH)2CO3
[Cu(OH)2·CuCO3]或CuCO3
[答案](1)Cu2(OH)2CO3
[Cu(OH)2·CuCO3]或CuCO3 
 (2) C>O
(2) C>O
 (3)CH2OH(CHOH)4CHO
+ 2Cu(OH)2
(3)CH2OH(CHOH)4CHO
+ 2Cu(OH)2  CH2OH(CHOH)4COOH + Cu2O↓+
2H2O
CH2OH(CHOH)4COOH + Cu2O↓+
2H2O
 医学上可用这个反应检验尿液中的葡萄糖。
医学上可用这个反应检验尿液中的葡萄糖。
 (4)3Cu2O
+ 14HNO3
(4)3Cu2O
+ 14HNO3  6Cu(NO3)2
+ 2NO↑+ 7H2O
6Cu(NO3)2
+ 2NO↑+ 7H2O
 (5)金刚石、石墨、富勒烯(C60)或碳纳米管等。
(5)金刚石、石墨、富勒烯(C60)或碳纳米管等。
例1. 下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,B跟Cl2反应除生成C外,另一产物是盐酸盐。
用化学式号填写下列空格:

(1)A是__________。
(2)当X是强酸时,A、B、C、D、E、F均含同一种元素,F是__________。
(3)当X是强碱时,A、B、C、D、E、F均含同一种元素,F是__________。
(4)B跟Cl2反应的化学方程式是_______。
[解析]正盐A能与强酸反应生成气态氢化物,则A中含无氧酸根即非金属阴离子。该非金属单质可被O2连续两次氧化,分别生成两种氧化物,故A中含S2-。其转化过程是:
S2- H2S
H2S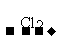 S
S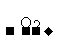 SO2
SO2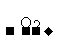 SO3
SO3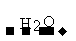 H2SO4
H2SO4
又因为正盐A能与强碱反应生成气态氢化物,则A中含NH4+。气态氢化物NH3中氮被Cl2置换后生成的HCl又与NH3化合成NH4Cl。其转化过程是:
NH4+ NH3
NH3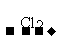 N2
N2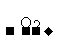 NO
NO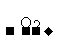 NO2
NO2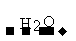 HNO3
HNO3
[答案](1)(NH4)2S (2)H2SO4 (3)HNO3
(4)H2S+Cl2=2HCl+S↓;8NH3+3Cl2=N2+6NH4Cl
例2:如下图所示的转化关系
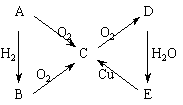
已知A为单质,试判断A、B、C、D、E各是什么物质,写出分子式。
|
|
A |
B |
C |
D |
E |
|
A为气体时 |
|
|
|
|
|
|
A为固体时 |
|
|
|
|
|
[解析]根据归纳出的“特征网络”:(1)A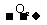 B
B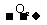 C
C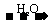 D(酸或碱),结合题目中“E
D(酸或碱),结合题目中“E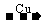 C”,能与Cu反应的是酸,且只有HNO3和浓H2SO4,即可推断出结果。
C”,能与Cu反应的是酸,且只有HNO3和浓H2SO4,即可推断出结果。
[答案]N2、NH3、NO、NO2、HNO3;S、H2S、SO2、SO3、H2SO4;
例3.下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
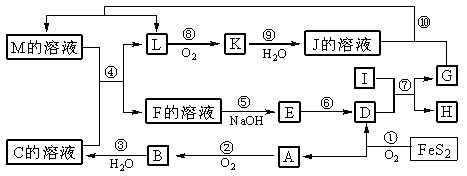
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
( 5 )将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:____________________________。
解析:解推断题的关键是找“题眼”。K是一种可由氧气与L反应得到的红棕色气体,可推知K是NO2,再推出J溶液为硝酸溶液。由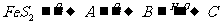 可推知A为SO2,B为SO3,C为H2SO4,由FeS2的煅烧可知D为铁的氧化物,由反应⑤⑥可推出:E为Fe(OH)3,
可推知A为SO2,B为SO3,C为H2SO4,由FeS2的煅烧可知D为铁的氧化物,由反应⑤⑥可推出:E为Fe(OH)3,
D为Fe2O3,结合I是由第三周期元素组成的单质中熔点最高的金属,可得I为Al,根据铝热反应及题中信息G为单质得G为Fe,H为Al2O3,,则M为Fe(NO3)2或Fe(NO3)3,又M能与C溶液反应(H2SO4)反应,则M只能是Fe(NO3)2。
答案:(1)四(或4);Ⅷ (2)1:2 (3)③ (4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O
(5)Fe2O3+3KNO3+4KOH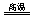 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
17.(1)愤怒(生气)(1分)
原因:这是分裂祖国的行为;违背了全国各族人民的共同心愿;没有履行公民应维护国家统一、民族团结的义务;与国家和人民的根本利益背道而驰;这种行为危害社会、对国家民族造成重大损失,不利于和谐社会的建设;或者从民族团结的意义角度阐述,没有歧义的答案及其它言之有理的答案亦可 (写出任意2点得2分)
(2)犯罪行为(刑事违法行为)(1分)
犯罪的含义或特征(3分)
(3)公民应承担的对国家的责任:维护国家的尊严是每个公民应尽的责任,国家处在困难时刻,最能考验公民的责任意识。(写到任一点得1分)
青少年应该做到:三个尊重;支持拥护党和国家的民族政策;与破坏民族团结的行为作斗争(任意两点得2分)
16.(1)直面挫折,不畏不惧,不气馁,不消沉;她善于自我疏导、自我排解;她超越自我,积极进取,探索创新成功的新思路。(3分)
(2)自强是进取的动力;是一个人活出尊严、个性、实现人生价值的必备品质;是我们努力学习、健康成长、成就事业的强大动力;是一种民族精神,使中华民族自立于世界民族之林;是通向成功的阶梯。(答出其中的三点即可得3分。其他言之有理,也可。)
(3)理想是自强的航标,要树立坚定的理想,为之执着追求; 战胜自我是自强的关键,要战胜自我,战胜自己的弱点,战胜放任自我; 扬长避短是自强的捷径,要扬长避短,发现自己的兴趣和爱好,据此确定自己前进的方向;自强人生少年始。要抓住现在的大好时光,努力学习,奋发进取,培养自强品格,等。(4分)
(其他言之有理,如:确立明确的目标;做自己不感兴趣但有意义的事情;加强自我管理和约束;从小事做起,从现在做起。)
1.D 2.A 3.C 4.D 5.A 6.C 7.D 8.A 9.B 10.D 11.C 12.B 13.C 14.B 15.A
17. 2009年7月5日,乌鲁木齐发生了一起典型的境外指挥、境内行动,有预谋、有组织的打砸抢烧事件。在此次事件中,车辆被毁260部;受损门面房203间,民房14间,总过火面积56850平方米,全市共有220多处纵火点;死亡人数140人,受伤人员800多人。社会各界强烈谴责这种行径,呼吁珍惜和平稳定的社会环境。
(1)歹徒的暴行激起你怎样的情绪感受?产生这种感受的原因是什么?(3分)
(2)从违法行为的分类来看,进行打、砸、抢、烧破坏活动是哪一种违法行为?为什么?
(4分)
(3)请结合“公民应承担起对国家的责任”的有关知识,谈谈为了构建和谐民族关系,青少年应该怎样做?(3分)
南通市第三中学期中考试评分标准
思想品德
16. 北京残奥会开幕式文艺表演上,舞蹈《永不停跳的舞步》催人泪下。领舞者李月原本是一位学芭蕾的小女孩,在汶川地震中失去左腿,虽承受巨大内心痛苦,但她一刻也没放弃对芭蕾的追求,不想让舞蹈的梦想屈从于残酷的命运。她重新起舞,向世界、向伤残的小伙伴,也向自己证明:地震折不断我的梦想,超越自我,就仍能高高飞翔。
(1)李月面对挫折和逆境,是如何实现她的梦想的?(3分)
(2)自强的心理品质帮助李月走出痛苦,重新起舞。请结合李月的事迹,谈谈这种心理品质对实现人生目标的作用。(3分)
(3)李月是我们学习的榜样。请联系自身实际,谈谈你打算怎样磨砺自强这一心理品质。(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com