
7、如图1-6-20所示,电荷量为-5×10-3C的点电荷在匀强电场中沿半径为10㎝的半圆弧由A点运动到B点,已知电场强度E = 1.0×103 V/m,则此过程中电荷的电势能将如何变化?变化多大?
6.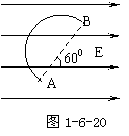 在匀强电场中的同一条电场线上相距10厘米的a、b两点,在8×10-3牛外力作用下把4×10-6库的负电荷匀速从a移到b,则a、b两点的电势差为 伏,电力线方向从 指向 ,以a为电势能零点,该负电荷在b处的电势能为 ,该匀强电场的电场强度为 。
在匀强电场中的同一条电场线上相距10厘米的a、b两点,在8×10-3牛外力作用下把4×10-6库的负电荷匀速从a移到b,则a、b两点的电势差为 伏,电力线方向从 指向 ,以a为电势能零点,该负电荷在b处的电势能为 ,该匀强电场的电场强度为 。
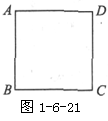
5. 如图1-6-19所示,一个匀强电场中有M、N、P三点,它们的连线组成一个直角三角形, MN=4厘米,MP=5厘米,当把电量是-2×10-9库的点电荷从M点移至N点时,电场力做功为8×10-9焦耳,而从M移到P时,电场力做功为8×10-9焦耳,此时电场的方向为
,电场强度大小为
。
如图1-6-19所示,一个匀强电场中有M、N、P三点,它们的连线组成一个直角三角形, MN=4厘米,MP=5厘米,当把电量是-2×10-9库的点电荷从M点移至N点时,电场力做功为8×10-9焦耳,而从M移到P时,电场力做功为8×10-9焦耳,此时电场的方向为
,电场强度大小为
。
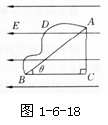
4.如图1-6-18所示,在场强为E的匀强电场中有相距为l的A、B两点,连线AB与电场线的夹角为θ,将一电量为q的正电荷从A点移到B点,若沿直线AB移动该电荷,电场力做的功W1= ;若沿路径ACB移动该电荷,电场力做的功W2= ;若沿曲线ADB移动该电荷,电场力做的功W3= 。由此可知,电荷在电场中的移动时,电场力做功的特点是 。
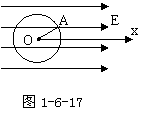
3.如图1-6-17所示,在沿x轴正向的匀强电场 中,有一动点A以O为圆心,r为半径做逆时针转动,当OA与x轴正向成θ角时,O、A两点间的电势差为
中,有一动点A以O为圆心,r为半径做逆时针转动,当OA与x轴正向成θ角时,O、A两点间的电势差为
 A.
A.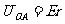 B.
B.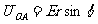
C.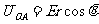 D.
D.
2. 如图1-6-16所示,A、B、C是某电场中同一条电场线上的三点。已知
如图1-6-16所示,A、B、C是某电场中同一条电场线上的三点。已知 =
= 。下列判断正确的是( )
。下列判断正确的是( )
A.φA>φB>φC
B.φA-φB=φB-φC
 C.EA>EB>EC
C.EA>EB>EC
D.EA = EB = EC
[要点导学]
电场强度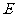 的物理意义的另一种表述
的物理意义的另一种表述
电场强度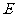 的大小描述沿电场线方向电势降落的 ,场强
的大小描述沿电场线方向电势降落的 ,场强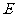 的方向是电势降落 的方向。根据这点,可以判断电场强度的方向。
的方向是电势降落 的方向。根据这点,可以判断电场强度的方向。
注意:场强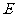 和电势
和电势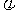 没有直接关系,场强
没有直接关系,场强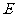 大只说明沿电场线方向电势
大只说明沿电场线方向电势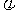 降落快,但电势
降落快,但电势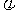 可大可小甚至可以是零;反之,电势
可大可小甚至可以是零;反之,电势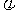 大时,场强
大时,场强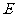 也可大可小甚至可以是零。它们之间的关系与加速度
也可大可小甚至可以是零。它们之间的关系与加速度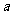 和速度
和速度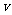 的关系相似。
的关系相似。
 [范例精析]
[范例精析]
例1 如图1-6-12所示,虚线方框内有一匀强电场,A、B、C为该
电场中的三个点。已知φA=12V,φB=6V,φC=-6V。试在该方框
中作出表示该电场的几条电场线,并要求保留作图时所用的辅助线(用
虚线表示)。
解析 由于电场线与等势面(线)互相垂直,且匀强电场中的电场
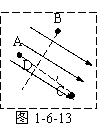 线和等势线均是间隔均匀、互相平行的直线,因此只要能确定电场中一条等势线,就可由A、B、C三点的电势高低,作出电场线。由题意可知,B点电势介于A、C之间,连接AC并将其三等分。由匀强电场特点可知:距A点三分之一AC处的D点与B点等势,连接BD则BD即为电场中的一条等势线;根据等势面(线)与电场线垂直作BD的垂线三条;因电势A高C低,故可得如图1-6-13所示的电场线。
线和等势线均是间隔均匀、互相平行的直线,因此只要能确定电场中一条等势线,就可由A、B、C三点的电势高低,作出电场线。由题意可知,B点电势介于A、C之间,连接AC并将其三等分。由匀强电场特点可知:距A点三分之一AC处的D点与B点等势,连接BD则BD即为电场中的一条等势线;根据等势面(线)与电场线垂直作BD的垂线三条;因电势A高C低,故可得如图1-6-13所示的电场线。
 拓展 “电场线和等势线均是间隔均匀、互相平行的直线”以及“沿任意方向电势均匀变化”是匀强电场的固有特性,这也是解决本题的重要依据。
拓展 “电场线和等势线均是间隔均匀、互相平行的直线”以及“沿任意方向电势均匀变化”是匀强电场的固有特性,这也是解决本题的重要依据。
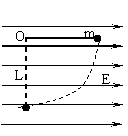
例2 在场强为E的水平方向的匀强电场中,有
一质量不计的轻杆,可绕杆的一端点O自由的转
动,另一端连一质量为m的带正电的小球,把杆
拉成水平后由静止释放,如图1-6-14所示。若小
球达到最低位置时速度恰好为零,则小球所带的
|
 解析:在水平的匀强电场中,当轻杆由水平位置转至竖直位置时,质量为m,带正电,电量为q的小球,其电势能增加,重力势能减少,动能不变。小球电势能的增加量等于它克服电场力所做的功。
解析:在水平的匀强电场中,当轻杆由水平位置转至竖直位置时,质量为m,带正电,电量为q的小球,其电势能增加,重力势能减少,动能不变。小球电势能的增加量等于它克服电场力所做的功。
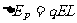 ,而重力势能减少了
,而重力势能减少了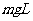 ,根据能量守恒定律得:
,根据能量守恒定律得:
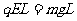 ,则小球所带电量为:
,则小球所带电量为: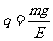
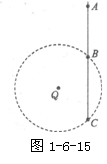
例3 如图1-6-15,在光滑绝缘竖直细杆上,套有一小孔的带电小球,小球质量为m,带电荷量为-q,杆与以正电荷Q为圆心的某一圆周交于BC两点,小球从A点无初速释放,AB=BC=h,小球滑到B点时速度大小为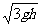 ,求小球滑到C点时速度的大小及AC两点间的电势差.
,求小球滑到C点时速度的大小及AC两点间的电势差.
解析 本题的电场是非匀强电场,UAC=Ed的公式已经不能使用。但是,因B、C为同一等势面上的两点,所以小球从B运动到C点的过程中,电场力做功为零,由动能定理得
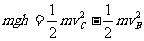
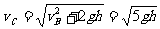
小球从A运动到C的过程中,由动能定理得
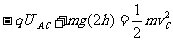
所以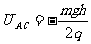
拓展 在研究带电粒子在电场中运动的问题时,应用动能定理是最佳选择。因为电场力做功与路径无关,所以只要选定初始状态和终了状态,动能定理的方程就容易建立,求解方程也十分方便。
[能力训练]
1.下列关于匀强电场强度和电势差的关系叙述正确的是( )
A.在相同的距离的两点上,电势差大的其场强也必定大
B.任意两点间的电势差等于场强和这两点距离的乘积
C.沿着电场线的方向任意相同距离上的电势差必定相等
D.电势减小的方向必定是场强的方向
22.(14分)如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
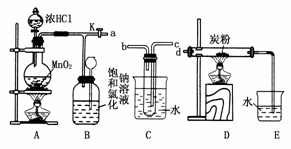
(1)要将C装置接入B和D之间,正确的接法是:
a→________→________→d。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛 有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是______________________________________ __________________________________
__________________________________
________________________________________________________________________。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是__________________________________,B的作用是______________________________________________________。
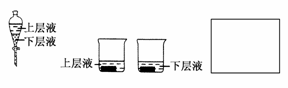
(4)用量筒量取20 mLE中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,呈黄绿色的是________(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是________(填“上层液”或“下层液”)。
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图_______________________________________________________
_________________________________ _______________________________________。
_______________________________________。
解析:(1)连接的关键是C装置的作用,由于D中反应生成了CO2和HCl,有氢元素存在,说明有水参加反应,反应方程式为2Cl2+C+2H2O4HCl+CO2,C装置的作用是提供水蒸气,而且Cl2从C中出来带出水蒸气,因此应该是长进短出。(2)C中提供水蒸气,烧杯中加入浓硫酸,浓硫酸溶于水放热,有利于水蒸气生成。(3)K关闭,此时B相当于量气装置,生成的气体将B中水压入长颈漏斗中。(4)此步操作是卤素单质的萃取,Cl2易溶于CCl4,而使CCl4层呈黄绿色,Cl2无漂白性,上层液主要是Cl2和水反应生成的HCl和HClO,HClO具有漂白性,可以使有色布条褪色。(5)由于D中反应生成了极易溶于水的HCl,E装置不正确,会造成E中水倒吸,可以用一个倒置的小漏斗防止倒吸。
答案:(1)c b
(2)2Cl2+C+2H2O4HCl+CO2 加入的浓硫酸溶于水能放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要
(3)瓶中液面下降,长颈漏斗内液面上升 贮存少量Cl2,避免Cl2对环境造成污染
(4)下层液 上层液
(5)D中反应生成的HCl气体极易溶于水,易发生倒吸
21.(12分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH、Cl-、Mg2+、Ba2+、CO、SO,为了确定溶液中所含离子及其物质的量浓度,某同学设计实验如下:
取三份100 mL上述水溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液,加热,收集到气体896 mL(标准状况)。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,请回答:
(1)溶液中肯定存在的离子是________;哪些离子的浓度能确定,分别是________________________________________________________________________。
(2)肯定不存在的离子是________,理由是_____________________________
________ ______________________________________________________________。
______________________________________________________________。
(3)可能存在的离子是________,如何确定? ________________________。
答案:(1)NH、K+、CO、SO
c(NH)=0.4 mol/L,c(CO)=0.2 mol/L,c(SO)=0.1 mol/L
(2)Mg2+、Ba2+ 因为溶液中存在CO、SO,Mg2+、Ba2+不能与CO、SO共存
(3)Cl- 再取一定量原溶液加入足量的Ba(NO3)2溶液。将得到的沉淀过滤,再向滤液中加入稀HNO3酸化的硝酸银溶液观察是否有沉淀生成,若有沉淀生成说明原溶液中有Cl-,否则没有Cl-。
19 .(10分)(2008·山东泰安5月)短周期常见元素形成的单质或化合物A、B、C、D、E转化关系如图所示(反应条件已略去):
.(10分)(2008·山东泰安5月)短周期常见元素形成的单质或化合物A、B、C、D、E转化关系如图所示(反应条件已略去):
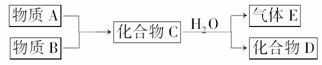
物质A与物质B之间的反应不在溶液中进行,E可能与A、B两种物质中的某种相同。
请回答下列有关问题:
(1)若C是离子化合物,D是一种强碱,则C物质的电子式为________;
(2)若C与水发生复分解反应,E的水溶液呈弱酸性,D既能与强酸反应又能与强碱反应。
①D与NaOH溶液反应的离子方程式为____________;
②E与NaOH(物质的量之比为1?2)反应后的溶液中,所有离子浓度之间的关系为______________________(列等式)。
(3)若C是一种气体,D是一种强酸。
①A与B反应的化学方程式为______________________。
②组成D的各元素的原子半径由大到小的顺序为____________________________。
解析:(1)C与水反应能形成强碱且生成气体,C应为Na2O2,E为O2,D为NaOH。
(2)根据题意,D为两性化合物,为Al(OH)3,E的水溶液显弱酸性,得:C应该是Al2S3,E是H2S。当H2S与NaOH按1?2反应时,应该得到Na2S。由电荷守恒得c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)。
(3)C与H2O生成一种强酸和一种气体,C应为NO2,E为NO,化合物D为HNO3。
答案:(1)Na+[?····?····?]2-Na+
(2)①Al(OH)3+OH-===[Al(OH)4]-
c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
(3)①2NO+O2===2NO2
②N>O>H或N、O、H
20.(10分)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去)。
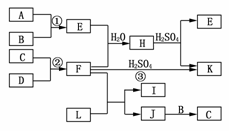
已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
(b)反应①、②是化工生产中的重要反应。
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。
(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。
(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)反应③的化学方程式_________________________________________________。
(2)C的结构式__________________;H的化学式________________。
(3)L的溶液与化合物E反应的离子方程式:
_____________________________________________________________________。
(4)化合物J的化学式___________________________。
解析:本题的突破口是E。由于B、C、D是非金属单质,且其中A不是气体,结合“化合物E是形成酸雨的污染物之一”不难推出E为SO2,A为S,B为O2;再根据“反应②是化工生产中的重要反应”及“FK”,且“K是常用的氮肥”可推出F为NH3,则C、D为N2、H2;再结合“JC”和“J由两种元素组成,其相对分子质量为32”,可推出C只能为N2,J为N2H4;又根据“L具有漂白性,可由Cl2与NaOH溶液反应而制得“可推出L为NaClO。
答案:(1)2NH3+H2SO4===(NH4)2SO4
(2)N≡N (NH4)2SO3或NH4HSO3
(3)ClO-+SO2+2OH-===Cl-+SO+H2O
(4)N2H4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com