
3.通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半满”、“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实能作为这个规则证据的是:
A.元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
B.26Fe2+容易失电子转变成26Fe3+,表现出较强的还原性
C.基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
D.某种激发态碳(C)原子排布式为1s22s12p3而不是1s22s22p2
2.已知:X、Y是同周期的主族元素,且电负性X>Y,下列说法错误的是:
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
1.现有四种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4; ②1s22s22p63s23p3;
③1s22s22p3; ④1s22s22p5。
则下列有关比较中正确的是:
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
2.元素在周期表中的位置与元素性质的关系
|
性
质 |
同周期(从左往右) |
同主族(自上而下) |
|
(1)能层数 |
相同 |
从1递增到6(或7) |
|
(2)最外层电子数 |
从1递增到8(第一周期例外) |
相同 |
|
(3)原子半径 |
减小(稀有气体除外) |
增大 |
|
(4)金属性(原子失电子能力) |
减弱 |
增强 |
|
(5)非金属性(原子得电子能力) |
增强 |
减弱 |
|
(6)电负性 |
增强 |
减弱 |
|
(7)第一电离能 |
增大的趋势 |
减小 |
|
(8)单质还原性 |
减弱 |
增强 |
|
(9)单质氧化性 |
增强 |
减弱 |
|
(10)最高价氧化物对应水化物的酸碱性 |
碱性减弱,酸性增强 |
碱性增强,酸性减弱 |
|
(11)非金属形成气态氢化物的难易程度 |
由难到易 |
由易到难 |
|
(12)气态氢化物的稳定性 |
增强 |
减弱 |
|
(13)主要化合价 |
最高正价从+1递增到+7(O、F例外),最低负价从第ⅣA族-4递增到-1 |
相同 |
|
(14)离子半径 |
r(阴离子)减小,r(阳离子)减小,r(阴离子)> r(阳离子) |
增大 |
[典型例析]
例1:各电子层排布的总数遵循三条规律:原子的最外层电子数≤8;原子的次外层电子数≤18;原子的倒数第三层电子数≤32。决定这三条规律的电子排布规则是
A.能量最低原理
B.泡利不相容原理
C.洪特规则
D.能量最低原理和泡利不相容原理
变式训练:
“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是
A.构造原理 B.泡利原理
C.洪特规则 D.能量最低原理
例2:现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 _____________ 。
变式训练:
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,写出A元素最外层电子的轨道表示式__________________;A元素形成的气态氢化物中A原子的杂化类型为__________;VSEPR理想模型为____。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为_______,C的元素符号为______;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为___________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_______________________。
[当堂反馈]
1.核外电子在排布时遵循以下原理或规则:
(1)构造原理:
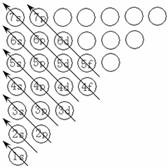
从图中可以看出不同能层的能级有交错现象,如E(3d) > E(4s)、E(4d) > E(5s)、E(5d) > E(6s)等。在1~36号元素中,原子核外电子排布不符合构造原理的元素有铬(Cr)、铜(Cu),最外层电子排布为ns1的元素有H、锂、钠、钾、铬、铜。
(2)能量最低原理:原子核外电子的排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。处于最低能量的原子称为基态原子,电子吸收能量后,跃迁至较高能级时称为激发态原子。
(3)泡利(Pauli)(不相容)原理:1个原子轨道里最多只能容纳2个电子且自旋方向相反。
(4)洪特(Hund)规则:当电子排布在同一能层的不同轨道时,总是优先单独占据一个轨道且自旋方向相同;洪特规则的特例当原子轨道处于全空、半满或全满时原子较稳定。
3、用有色笔在图上画出
甜菜和甘蔗的分布区。
2、请填注商品棉基地:
A
B
C
D
E
1、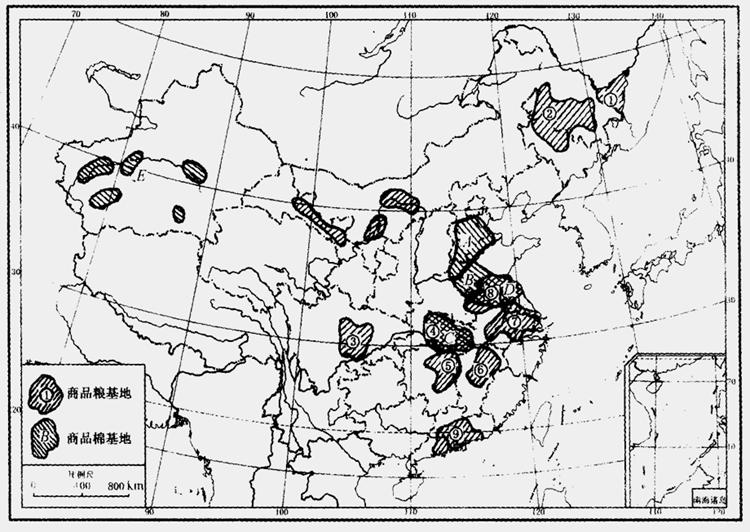 请填注商品粮基地:
请填注商品粮基地:
①
②
③
④
⑤
⑥
⑦
⑧
⑨
22.下面是一篇“中国首届全球通手机短信文学大赛”散文类获奖作品,请你为这篇作品写几句评点的话。(80 字左右)(5分)
山里的母亲
母亲这辈子只识得三个字,那就是她的名字。母亲这辈子只做一件事,那就是劳动。母亲这辈子只有一个愿望,那就是让三个孩子走出这山。母亲这辈子唯一的欣慰,那就是她的孩子秉承了她的执著和坚韧。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com