
17.若在现代原子结构理论中,假定每个原子轨道只能容纳一个电子,则原子序数为42的元素的核外电子排布式将是怎样的 ________________________________;按这种假设而设计出的元素周期表,该元素将属于第________周期,第_______族。
16.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);
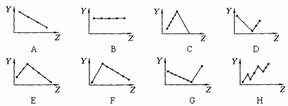 把与下面的元素有关性质相符的曲线的标号填入相应括号中:
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数( )
(2)ⅦA族元素氢化物的沸点( )
(3)第三周期元素单质的熔点( )
(4)第三周期元素的最高正化合价( )
(5)IA族元素单质熔点( )
(6)F-、Na+、Mg2+、Al3+四种离子的离子半径( )
(7)短周期元素的原子半径( )
(8)短周期元素的第一电离能( )
15.下列物质转化关系中,A是人类最早通过“湿法冶炼”得到的金属单质,也是人类最早用作制镜的材料,K是现在用作制镜材料的金属单质,I为日常生活中最常见的金属之一;E是由两种核电荷数均小于10的元素组成的化合物,其中一种元素的原子半径在所有原子中最小,另一种元素的基态原子最外能层中的p能级处于半充满状态;K元素和A元素在元素周期表中处于同一列且比A元素多18个电子;H是深蓝色溶液,J是含有K离子的可溶性盐(下列物质转化关系中与本题无关的物质均被略去)。回答下列问题:
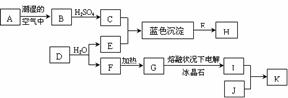
(1)A的化学式为 ,H中阳离子的化学式为 ,空间构型为___________形。
(2)G转化为I的化学方程式是 ;
(3)D由两种元素组成,且这两种元素在D中的物质的量之比为1∶1,D转化为E、F的反应为复分解反应,请写出该反应的化学方程式 ;
(4)在J溶液逐渐加入过量E的水溶液,会发生类似于C转化为H的过程而形成一种配离子,该配离子的中心离子配位数为2,且该中心离子采用sp杂化与E分子结合。该配离子的化学式为 ,空间构型为 。
14.按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个能层且只含1个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三能层上有8个电子,第四能层上只有1个电子;E原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出5个):___________________________
;
(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出2个):_____________________________
____ ;
(3)检验某溶液中是否含有D+的离子,可通过______________反应来实现;检验某溶液中是否含有B-的离子,通常所用的试是_________和_______。
(4)写出E的元素符号___________,要证明太阳上是否含有E元素,可采用的方法是______________________。
13.甲、乙、丙、丁、戊五种元素,其中甲元素原子核外L层上s能级和P能级电子个数相同;乙元素原子3p能级上只有1对成对电子;丙和丁元素原子N层上都只有1个电子,但其中丙元素原子各内层均已充满,而丁元素原子次外层的电子充满在2个能级中;戊元素原子最外层电子轨道表示式是 ,它的单质常温时为气态。试用化学符合回答以下问题。
,它的单质常温时为气态。试用化学符合回答以下问题。
(1)甲是 ,乙是 ,丙是 ,丁是 ,戊是 。
(2)丙和乙的单质发生化合反应的化学方程式是 。
(3)丙的硝酸盐溶液跟乙的气态氢化物发生反应的离子方程式是 。
(4)甲和乙元素组成的化合物的化学式是 _。
用电子式表示该化合物的形成过程 _____。
(5) 丙元素原子最外层电子排布是 。
(6) 乙和丁形成的化合物的电子式是 。
12.下图是N、O、F三种元素基态原子电子排布的轨道表示式。试回答下列问题:

(1)N、O、F形成氢化物的分子组成,与对应的三种元素基态原子内的电子排布有什么关系?
(2)画出C原子基态原子电子排布的轨道表示式。
(3)根据你发现的规律,对基态C原子形成CH4分子的微观过程提出合理的猜想。
11.下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
|
元素名称 |
钪 |
钛 |
钒 |
铬 |
锰 |
|
元素符号 |
Sc |
Ti |
V |
Cr |
Mn |
|
核电荷数 |
21 |
22 |
23 |
24 |
25 |
|
最高正价 |
+3 |
+4 |
+5 |
+6 |
+7 |
(1)写出下列元素基态原子的核外电子排布式:
Sc____________________________、
Ti_____________________________、
V _____________________________、
Mn ____________________________。
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是:_______________________________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是______________________
_______________________________________________;出现这一现象的原因是___________________________
_______________________________________________。
10.人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,错误的是
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
9.元素X原子的最外层电子排布为ns1,元素Y和Z的基态原子2p能级上均有两个未成对电子,且原子序数为Y大于Z。则X、Y、Z三种元素组成的化合物的分子式可能是
A.X2ZY3 B.X2ZY4 C.X2ZY D.X3ZY3
8.基态原子的4s能级中只有1个电子的元素共有
A.1种 B.2种 C.3种 D.8种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com