
4.已知离心率为e的双曲线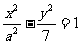 ,其右焦点与抛物线
,其右焦点与抛物线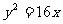 的焦点重合,则e的值为 ( )
的焦点重合,则e的值为 ( )
A.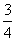 B.
B.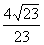 C.
C.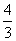 D.
D.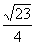
3.函数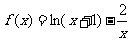 的零点所在的区间是 ( )
的零点所在的区间是 ( )
A.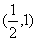 B.
B.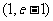 C.
C.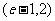 D.
D.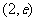
2.一个空间几何体的三视图及其尺寸如下图所示,则该空间几何体的体积是 ( )
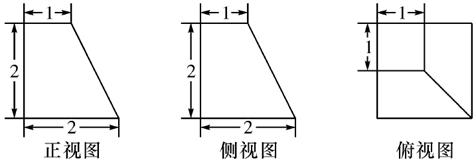
A.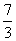 B.
B.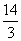 C.7 D.14
C.7 D.14
1.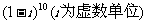 的二项展开式中的第七项为 ( )
的二项展开式中的第七项为 ( )
A.-210 B.210 C.-120i D.120i
21.(12分)已知:G 是一种常用的药用有机物,合成路线如图所示:
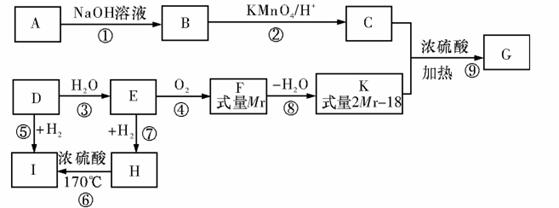
①有机物A 和C都能与FeCl3发生显色反应,且每个分子中两个取代基处于邻位,5.4gA
与标准状况下9.52LO2 刚好完全燃烧生成15.4gCO2 和3.6gH2O;
②有机物G只含碳、氢、氧元素且式量小于200,氧元素的质量分数为35.56%。请回
答:
(1)写出A、C的结构简式A ,C 。
(2)反应②~⑨中,属于取代反应的有 (填序号)。
(3)写出F的常见同分异构体与F在浓硫酸作用下反应的化学方程式
。
(4)写出G在加热条件下与NaOH溶液反应的化学方程式
。
(5)写出反应⑥的方程式 。
20.(10分)A、B、D、E 四种短周期元素,其原子序数逐渐增大。A 元素原子的核外电子数、电子层数和最外层电子数均相等,B、D、E 三种元素在周期表中相对位置如图①所示,E 的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z 七种物质均由A、B、D 三种元素中的一种或几种组成,其中只有M 分子同时含有三种元素;W 为A、B 两元素组成的18 电子分子,可做火箭燃料;甲、乙为非金属单质;X 分子含有10个电子。它们之间的转化关系如图②。
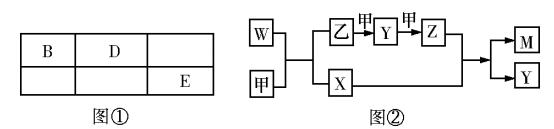
回答下列问题:
(1)Z的化学式为 。
(2)E 的单质与水反应的离子方程式为 。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20% ~30%的KOH溶液。W-空气燃料电池放电时,负极反应式为 。
 (4)将一定量的A2、B2 的混合气体放入2L密闭容器中,在500°C、2°C×107 Pa下达到平衡。测得平衡气体的总物质的量为0.5mol,其中A2 为0.3mol,B2 为0.1mol。则该条件下A2 的平衡转化率为 ,该温度下反应2BA3(g )
3A2(g)+B2(g)的平衡常数为
。
(4)将一定量的A2、B2 的混合气体放入2L密闭容器中,在500°C、2°C×107 Pa下达到平衡。测得平衡气体的总物质的量为0.5mol,其中A2 为0.3mol,B2 为0.1mol。则该条件下A2 的平衡转化率为 ,该温度下反应2BA3(g )
3A2(g)+B2(g)的平衡常数为
。
19.(10分)A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
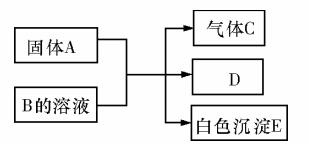
(1)若A是短周期中原子半径最大的元素构成的单质,E 既可溶于盐酸又可溶于NaOH
溶液,E 溶于NaOH 溶液的离子方程式为 ;工业上冶炼
A 的化学反应方程式为 。
(2)若A为红色金属,B 为某酸的浓溶液,C 为可形成酸雨的无色气体。则A 与B反应的化学方程式为 。
(3)若B为某酸式盐的溶液,C 是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式为 ;0.1molC 完全燃烧生成液态水时放热130kJ·mol-1,则表达C 燃烧热的热化学方程式是 。
18.(10分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
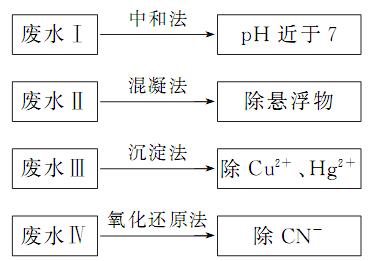
(1)废水I若采用CO2处理,离子方程式是 。
(2)废水II常用明矾处理。实验中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
(3)废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2+ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05mg/L。某工厂排放的1m3废水中含Hg2+ 3×10-4mol,是否达到了排放标准 (填“是”或“否”)。
(4)废水IV常用Cl2将CN-氧化成两种无毒气体,则该反应的离子方程式为
.
17.(10分)二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。
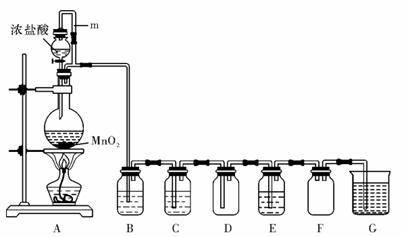
(1)圆底烧瓶中发生反应的化学方程式为 。
(2)A 中m 管的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 。
(4)E中若装有FeCl2 溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,长郡中学高二化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;
实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
16.25°C时,下列关于分别由等体积0.1mol/L的2种溶液混合而成的溶液的说法中,不正确的是 ( )
A.Ba(OH)2溶液与Na2SO4溶液:pH=13
B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.Na2CO3溶液与NaOH溶液:c(Na+)>c(CO2-3)>c(OH-)>c(H+)
D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO2-3)+3c(HCO-3)+3c(H2CO3)
第Ⅱ卷 非选择题(共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com