
17.已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20ml0.01 mol•L-1氨水中的Ksp比在20mL
16.反应⑴、⑵分别是从海藻灰和智利硝石中提取碘的主要反应:
2 NaI + MnO2 + 3 H2SO4 = 2 NaHSO4 + MnSO4+2 H2O + I2 ………⑴
2 NaIO3 + 5 NaHSO3 = 2 Na2SO4 + 3 NaHSO4 + H2O + I2 ………⑵
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.I2在反应⑴中是还原产物,在反应⑵中是氧化产物
C.氧化性:MnO2>SO42->IO3->I2
D.反应(1)、(2)中生成等量的I2时转移电子数之比为1:5
13.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl+S+SO2。SOCl2易挥发,在空气中遇水蒸气会产生大量白雾,下列说法不正确的是
A.电池的负极反应为:Li-e- ==Li+
B.碳电极上的反应:2SOCl2 +4e- ===4Cl- +S +SO2。
C.组装该电池必须在无水、无氧的条件下进行
D.电池工作时Li+向负极移动
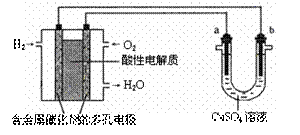 14.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如右图所示。下列说法中,正确的是
14.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如右图所示。下列说法中,正确的是
A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
 15.可逆反应a A(s)+b B(g)
15.可逆反应a A(s)+b B(g) c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
A.达平衡后,加入催化剂则C%增大
B.达平衡后,若升温,平衡左移
C.化学方程式中c +d > a + b
D.达平衡后,增加A的量有利于平衡向右移动
12.某研究小组采用往一定体积的食醋中滴入已知浓度的NaOH溶液的方法测定食醋中醋酸的浓度。下列说法正确的是
A.滴定时,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
B.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
C.碱式滴定管若滴定前平视读数、滴定后俯视读数,则测定结果偏高。
D.酸式滴定管用水洗净后未用食醋润洗,则测得的食醋浓度偏高
11.将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①=②>③>④ B.①=②>③=④ C.①>②>③>④ D.①>②>④>③
10.0.3 mol硼烷(B2H6)在氧气中完全燃烧生成B2O3固体和液态水,放出649.5 kJ热量。下列判断正确的是
A.该反应是非氧化还原反应
B.在理论上可以利用该反应的原理做成燃料电池
C.该反应的热化学方程式为:
B2H6(g)+3O2(g)
= B2O3(s) +3H2O(l); H= +2165 kJ/mol
H= +2165 kJ/mol
D.每生成18 g水,该反应转移2 mol电子
9.相同物质的量浓度的NaCN 和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN 和 HClO说法正确的是
A.酸根离子浓度:c(CNˉ)<c(ClOˉ)
B.pH:HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.电离程度:HCN>HClO
8.为了增强漂白粉的漂白能力,对漂白粉溶液作如下处理,其中达不到目的的操作是
A.微热 B.加醋酸溶液 C.通CO2气体 D.加烧碱溶液
7.25℃、101kPa下,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol能自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.熵增效应大于热效应
6.欲使0.1mol/L NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3¯)都减少,方法是
A.加入氢氧化钠固体 B.加水
C.通入氯化氢气体 D.加入饱和石灰水溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com