
3.(1999年全国高考题)下列各分子中所有原子都满足最外层为8电子结构的是 ( )
A.BeCl2 B.PCl3 C.PCl5 D.N2
(本题考查对成键原子最外层8电子结构的辨证认识)
2.(2002年上海高考题)在下列有关晶体的叙述中错误的是 ( )
A. 离子晶体中,一定存在离子键
B. 原子晶体中,只存在共价键
C. 金属晶体的熔沸点均很高
D. 稀有气体的原子能形成分子晶体
(本题考查晶体的结构和性质,答题时要注意晶体结构特征和思维的辨证性)
1.(2002年上海高考题)下列分子的电子式书写正确的是
( )
A 氨  B
四氯化碳
B
四氯化碳

C 氮 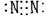 D 二氧化碳
D 二氧化碳 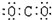
(本题考查电子式的书写,答题时注意物质类型和书写形式)
6.了解几种典型物质如氯化钠、氯化铯、金刚石、二氧化硅、干冰以及石墨等晶体的空间结构特征,培养对原子、分子、化学键等微观结构的一定的三维空间想象能力。
典型题点击
5.晶体性质(硬度大小、熔沸点高低等物理性质)的比较依据
⑴异类晶体:一般来说,晶体的熔沸点:原子晶体>离子晶体>分子晶体,而金属晶体却差别很大。
⑵同类晶体:①原子晶体的熔沸点取决于共价键的强弱(一般比较原子半径的大小);②离子晶体的熔沸点取决于离子键的强弱(离子半径越小,离子电荷数越多,离子键越强)③分子晶体的熔沸点取决于分子间作用力的大小(含氢键)。
4.晶体类型的分类及判断方法
可据元素组成来判断:金属单质为金属晶体;金刚石、晶体硅、二氧化硅、碳化硅等为原子晶体;含金属阳离子或铵根离子的化合物为离子晶体;其他由非金属元素组成的单质和化合物为分子晶体。
3.电子式的书写方法
⑴要区别“用电子式表示物质的形成过程”和“用电子式表示物质”的提法不同,表示也应不同。
⑵注意离子化合物与共价化合物表示上的区别,如是否用[]及“+”“-”等。
⑶注意一些较复杂化合物电子式的正确书写。如Na2O2、H2O、HClO、Al2O3、Mg3N2、(NH4)2S、Ba(OH)2等。
2.分子极性的判断:⑴单质分子一般为非极性分子;⑵化合物①AB型分子全为极性分子, ② ABn型分子:若A的化合价等于其价电子数目,则分子的空间结构对称,其分子为非极性分子;若A的化合价不等于其价电子数目,则分子的空间结构不对称,其分子为极性分子。
1.化学键包括离子键、共价键和金属键,应从原子结构的特征出发分析单质和化合物的粒子(分子、离子、原子)间的强烈相互作用所形成的化学键,切实掌握化学键的概念、分类、实质与特征,了解键的极性;并注意与分子间作用力和氢键的区别。
16.⑴
⑵n(Ni3+):n(Ni2+)=6:91
讲析:⑴如图所示,以立方体作为计算单元,此结构中含有Ni2+-O2-离子数为:4× =
= (个),所以1molNiO晶体中应含有此结构的数目为6.02×1023÷
(个),所以1molNiO晶体中应含有此结构的数目为6.02×1023÷ =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为

⑵解法一(列方程):设1molNi0.97O中含Ni3+为xmol,Ni2+为ymol,则得
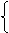 x+y=0.97 (Ni原子个数守恒)
x+y=0.97 (Ni原子个数守恒)
3x+2y=2 (电荷守恒)
解得x=0.06,y=0.91,故n(Ni3+):n(Ni2+)=6:91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有

 Ni3+ 3
0.06/0.97
Ni3+ 3
0.06/0.97

 2/0.97
2/0.97
Ni2+ 2 0.91/0.97
故n(Ni3+):n(Ni2+)=6:91。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com