
5.(1)KIO3;0.5
(2)决定反应速率的一步反应是慢反应①
(3)I2会使淀粉变蓝,从反应过程和机理看,只有当SO32-消耗完,才会有I2存在。
检测提高
1.B 2.C 3.BC 4.AC
讲析:1.由题知2s时C的浓度为0.6mol/L,根据化学方程式中化学计量数比,可算出B的变化浓度为0.3 mol/L,进而确定B的浓度是(1 mol/L-0.3 mol/L)=0.7 mol/L;A的变化浓度为0.6 mol/L,从而求A的转化率为30%;用C表示的反应的平均速率为0.3mol·(L·min)-1,可推知用A表示的反应的平均速率为0.3 mol·(L·min)-1,用B表示的反应的平均速率为0.15 mol·(L·min)-1。对照各选项,符合题意的是B。 2.开始时盐酸浓度和镁带表面积会影响反应速率,又因此反应为放热反应且有H2产生,则温度和容器的密闭情况也成为影响该反应速率的因素。 3.加入碳酸钠固体,反应掉硫酸,会使生成氢气总量减少,A不选;加入水,溶液中c(H+)减低,反应速率减缓,但溶液中H+的物质的量不变,故生成氢气总量不变,B可选;加入硫酸钾溶液,相当于加水稀释,C可选。加入硫酸铵固体,显然不能减慢反应速率,D不选。故答案为B、C。 4.C为固态反应物,增加其用量对反应速率几乎没有影响;容器体积缩小一半相当于压强增大一倍,浓度增大,正、逆反应速率均增大;体积不变,充入N2体系总压强增大,但反应混合物浓度并未改变,反应速率基本不变;充入N2使容器体积增大,总压强不变,但反应混合物浓度同等程度变小,正、逆反应速率均变慢。
10.(1)3X+Y 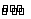 2Z
2Z
(2)0.05 mol·(L·min)-1;0.04 mol·(L·min)-1
(3)5min时,反应达到了平衡,各物质的反应速率不再改变,故5min后Z的生成速率与5min末Z的生成速率相等。
第11课时 (B卷)
纠错训练
9.(1)2KCl O3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大,化学反应速率加快。
(2)随着反应的进行,H2SO4和NaHSO3之间反应使H+及HSO3-浓度减小,后期化学反应速率减慢。
8.(1)0.25 mol·(L·min)-1 (2)0.25 mol·(L·min)-1
(3)因在同一反应里,v(HCl)=2 v(FeCl2),对比前2min和后4min的反应速率知前2min时HCl的浓度较大,所以前2min反应速率较快(实际上随着反应的进行,反应物浓度不断减小,反应速率肯定要减慢。)
7.升高温度和使用催化剂。升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子;使用催化剂能够降低反应所需要的能量,从而使更多的反应物分子成为活化分子;因此,升高温度和使用催化剂都可以增大反应物分子中活化分子的百分数。
2.0m=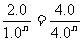 则n=1/2
则n=1/2
1.0n=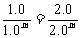 则m=1
则m=1
选择c(H2)=2.0 mol/L的两种情况:
1.C 2.CD 3.A 4.BD 5.D 6.B
讲析:2.若反应物为固体或纯液体,增大其量对反应速率无影响。压强只是对有气体参加或生成的反应而言,改变压强会改变速率。3.温度升高,反应速率都增大。对于一个可逆反应来说,吸热反应速率增大的倍数比放热反应增大的倍数要大。5. 选择c(Cl2)=1.0 mol/L的两种情况:
4.(1)反应速率可用反应物的消耗速率,也可用产物的生成速率来表示。(2)直线、抛物线。(3)Ni,它的腐蚀速率随时间的增长比镁的要慢。
讲析:4.(1)金属因高温氧化反应,遭到破坏是常见的一种腐蚀现象。然而,不同的金属因其所形成的氧化膜致密程度不同,它们的耐腐蚀性亦不同。化学反应的快慢既可由反应物消耗速率表示,也可由生成物的生成速率来表示,显然,金属的腐蚀速率可用其氧化膜的生长速率表示。(2)根据题给数据不难导出以下数学关系式:MgO膜厚Y与时间t的关系为:Y=0.05at;NiO膜厚Y’与时间t的关系为Y’=bt1/2。由数学知识知,前者为直线型,后者为抛物线型。(3)据此可知Y’随时间t增长要比Y随时间t增长得慢,故而镍的耐高温氧化腐蚀性要比镁的好。
新活题网站
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com