
2.(2002年全国高考题)1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a Y(g) b Z(g)
b Z(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A.a=1,b=1 B.a=2,b=1
C.a=2,b=2 D.a=3,b=2
(本题考查学生利用化学方程式进行计算的基本技能,内容还涉及常用的化学计量,如气体体积、密度和物质的量之间的关系以及阿伏加德罗定律等基础知识。解题时,要综合应用这些基础知识和基本技能。)
1.(2001年上海高考题)利用天然气合成氨的工艺流程示意如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
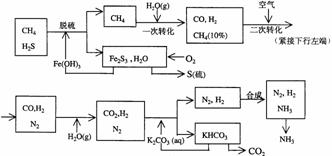
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒夏特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
(此题主要结合化工生产实际,考查无机和有机化学反应的基本知识,以及运用化学平衡移动的原理解决化学实际问题的能力。答题时要看懂天然气合成氨的工艺流程示意意图,结合反应原理加以分析。)
4.化学平衡的有关计算,有相当一类题型“貌似计算,实则可推”,解题的关键往往借用假设法、极值法、途径法、终态法、守恒法、差量法等。
典型题点击
3.关于化学平衡计算的一般思路和方法
建立模式、确定关系、依据题意、列出方程
化学平衡的计算模式:mA(g)+nB(g)  pC(g)+qD(g)
pC(g)+qD(g)
起始浓度(mol/L) a b c d
变化浓度(mol/L) mx nx px qx
平衡浓度(mol/L) a-mx b-nx c+px d+qx
(1)A的转化率=mx/a×100%(量:物质的量、浓度、体积、质量等)
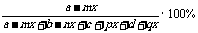 (2)各组分体积分数
(2)各组分体积分数
如φ(A)=
 (3)平均相对分子质量的变化规律
(3)平均相对分子质量的变化规律
 =
=  如何变化取决于m总和n总的变化情况
如何变化取决于m总和n总的变化情况
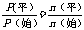 (4)气体状态方程的应用
(4)气体状态方程的应用
①T、V恒定时:

②T、P恒定时:
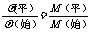
 ③T、P恒定时:
③T、P恒定时:
④T、P、V恒定时:
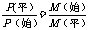
⑤T、m、V恒定时:
2.化学平衡原理的应用
(1)适用的平衡:适用于溶解平衡、电离平衡、水解平衡、络合平衡等。
(2)工业上应用:如合成氨工业、硫酸工业、硝酸工业、有机合成等。
1.合成氨适宜条件的选择
温度:500℃左右 压强:20MPa-50MPa为宜
催化剂:铁触媒
浓度:增大N2、H2的浓度、减小NH3的浓度
13.(1)恒温时,密闭容器中通入2molA(g)和1molB(g) 发生反应达平衡,压强一定时C的体积分数为0.4。若与上述平衡保持同温、同压,且n (A):n (B)=2:1,则为等效平衡,C的体积分数仍为0.4。
2A(g)+B(g)  2C(g)
2C(g)
起始物质的量(mol) 4 2 0
平衡物质的量(mol) 4-2x 2-x 2x
则有2x/(4-2x+2-x+2x)×100%=0.4 x=1
n(总)= 4-2x+2-x+2x=6-x=5
(2) 2A(g) +
B(g)  2C(g)
2C(g)
起始物质的量(mol) n(A) n(B) 0
平衡物质的量(mol) n(A)-2y n(B)-y 2y
据题意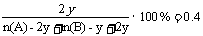
有:n(A)+n(B)=6y……①
且n(A)-2y>0…… ②
n(B)-y>0…… ③
联立①②③解得:0.5n(B)<n(A)<5n(B)
则a=0.5, b=5
12.
(1)n(P4 )=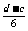 mol n(PH3
)=
mol n(PH3
)=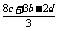 mol
(2)a>b+2c;
mol
(2)a>b+2c; 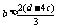
11.(1)③⑤④①②
(2)增大C(H+),使两个平衡向左移动,防止生成Na2CrO4
(3)因为Na2SO4的溶解度随温度升高而减小,所以应趁
热滤出Na2SO4晶体。
10.(1)D (2)降低;增大;<;增大体积使二氧化碳压强减小,平衡向右移动,由于正反应是吸热的,故使体系温度降低。在低于850℃的温度下,重新达平衡时,二氧化碳的压强必小于850℃的平衡压强4.94×104Pa。
讲析:(1)升温与加压,对平衡移动方向效果相反,故无法确定。
(2)根据图表数据,升高温度增大的倍数比气体压强增大的倍数要小,生成了更多的气体,可判断平衡向右反应方向为吸热反应,现减压平衡右移,故温度降低,压强变小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com