
4.Ba2++C2O42- BaC2O4
BaC2O4+2H+=Ba2++H2C2O4,Ba2C2O4在溶液中存在如下溶解平衡:BaC2O4(S) =Ba2++C2O42-,加入盐酸,H+与C2O42-反应生成弱电解质H2C2O4,使溶解平衡向右移动,沉淀溶解;
较强的酸与较弱的酸的盐反应生成较弱的酸。
检测提高
3.方法一:在醋酸溶液中滴入石蕊试液,溶液呈红色,加入醋酸铵固体,振荡溶液,溶液颜色明显变浅。C(H+)变小,是由于加入的CH3COO-使平衡向左移动,由此说明醋酸溶液存在醋酸的电离平衡。方法二:取一定体积的溶液,用pH试纸测其溶液的pH,然后再用蒸馏水将溶液稀释100倍,再测定溶液的pH,若稀释前后溶液的pH改变小于2,说明存在上述的电离平衡。
讲析:CH3COOH是弱电解质,溶于水后部分电离,溶液中存在电离平衡,如条件改变,电离平衡会发生移动,溶液中各种离子的浓度都会发生改变。再实验中,可通过验证氢离子的浓度的改变来证明醋酸再溶液中存在电离平衡。由于题目没有给定试剂和限定方法,故思考的空间比较大。
2.
|
|
初速率 |
氢气物质的量 |
|
(1)同体积同物质的量浓度 |
c>a>b |
c>a=b |
|
(2)同体积同pH值 |
c=a=b |
b>a=c |
1.①②⑧; ③④⑨;⑤;⑥⑦⑩
14. ⑴在“O”点处醋酸未电离,无离子存在 。⑵c<a<b 。 ⑶c ⑷C、E、F
第14课时 (B卷)
纠错训练
13. (1)100 mL溶量瓶(注:未标明规格的扣1分) (2)> b (3)配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒难以做到表面积相同 (4)配制NaA溶液,测其pH>7即证明HA是弱电解质
讲析:甲、乙两同学都是利用了第一个原理。0.1mol·L-1的HA溶液pH>1,说明c(H+)<0.1 mol·L-1也就说明了HA不能完全电离,为弱电解质。同pH的盐酸和HA用水稀释相同倍数后,由于HA是弱电解质,存在电离平衡,c(H+)减小程度小,溶液中c(H+)大于盐酸中c(H+),与锌粒反应速率快。再由原理二,就很容易地设计出另外一个更为简易的方案:配制NaA溶液,测其pH>7即证明HA是弱电解质。另外解此题第一问时,很易丢容量瓶的容积,要注意答题的严密性。
12. A
11.
|
条件 |
平衡移动方向 |
NH4+的物质的量 |
n(OH-) |
c(NH4+) |
|
加少量盐酸 |
正 |
增 |
减 |
增 |
|
加少量固体NaOH |
逆 |
减 |
增 |
减 |
|
加水稀释 |
正 |
增 |
减 |
减 |
|
通入NH3 |
正 |
增 |
增 |
增 |
|
升高温度 |
逆 |
减 |
减 |
减 |
|
加NH4NO3晶体 |
逆 |
增 |
减 |
增 |
1.D 2.A 3.C 4.AD 5.A 6.B 7.D 8.D 9.A 10.A
1.C 2.B 3.B 4.C
讲析:2.溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05
mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05
mol NaOH固体后,离子浓度增大,导电能力增强;只有0.5 mol·L-1的盐酸,能与NaOH反应生成强电解质NaCl,不影响导电性。
3.温度不变时,c(H+)和c(OH-)的乘积为常数,故排除C;稀释时电离度增大,c(OH-)的物质的量增大,故排除D;稀释时,NH3·H2O的物质的量减小,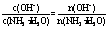 ,可知该分数值增加,故排除A选B。 4.D项加入水会增大CH3COOH的电离度,不符合题意。B选项加NH3·H2O,中和CH3COOH电离出的H+,增大CH3COOH溶液的pH,同时还增大CH3COOH的电离度,也不符合题意。A选项加入CH3COONa,增大了CH3CO0-离子浓度,抑制CH3COOH的电离,但同时也降低了c(H+)浓度,虽然电离度减小了,但pH增大了,也不符合题意。C选项加HCl,增大了c(H+)浓度,使CH3COOH电离平衡逆向移动,降低其电离度,又增加它的酸性,pH降低。
,可知该分数值增加,故排除A选B。 4.D项加入水会增大CH3COOH的电离度,不符合题意。B选项加NH3·H2O,中和CH3COOH电离出的H+,增大CH3COOH溶液的pH,同时还增大CH3COOH的电离度,也不符合题意。A选项加入CH3COONa,增大了CH3CO0-离子浓度,抑制CH3COOH的电离,但同时也降低了c(H+)浓度,虽然电离度减小了,但pH增大了,也不符合题意。C选项加HCl,增大了c(H+)浓度,使CH3COOH电离平衡逆向移动,降低其电离度,又增加它的酸性,pH降低。
新活题网站
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com