
2.理解并掌握弱电解质的电离平衡
⑴概念:在一定条件下下,当电解质分子电离成离子的速率与离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态。
 ⑵弱电解质的电离平衡的特点
⑵弱电解质的电离平衡的特点

1. 掌握强弱电解质与结构的关系
|
|
强电解质 |
弱电解质 |
|
定义 |
溶于水以后几乎完全电离的电解质 |
溶于溶于水以后几乎完全电离的电解质 |
|
电离特点 |
完全电离、不可逆、不存在电离平衡 |
部分电离、可逆、存在电离平衡 |
|
物质种类 |
强酸、强碱、多数盐、碱性氧化物 |
弱酸、弱碱、水 |
|
溶质粒子种类 |
水合离子、无溶质分子 |
水合离子和溶质分子共存 |
|
化学键 |
离子键、强极性键 |
一般为弱极性键 |
2.电解质溶液导电能力的强弱
⑴电解质溶液的导电机理:自由离子(阴阳)定向迁移形成电流。
⑵溶液的导电能力:主要由溶液中离子的浓度和电荷数决定
⑶溶液导电能力的影响因素:
内因: 电解质本身电离能力
外因:温度、溶液浓度等
1.正确判断电解质与非电解质
⑴凡溶于水或熔融状态下能导电的化合物叫电解质;溶于水和熔融状态下都不导电的化合物叫非电解质;要注意“或”与“和”字的区别和“化合物”三字的外延。
⑵单质既不是电解质,也不是非电解质。
⑶NH3、SO2虽然溶于水后都能导电且又是化合物,但在水溶液中不是其本身发生电离,应是非电解质。
20.(1)0.04mol/L (2)0.025mol/L
19.(1)H++Ac-=HAc HAc+OH-= Ac-+H2O
(2)H2CO3 NaHCO3 ,H3PO4 NaH2PO4
18.(1)C (2)E (3)A (4)D ;1 (5)E
17.(1)HCO +Br2=HBrO+Br-+CO2
(2)2CO
+Br2=HBrO+Br-+CO2
(2)2CO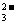 +Br2+H2O=BrO-+Br-+2HCO
+Br2+H2O=BrO-+Br-+2HCO
16. (1) 溶液变黄;加入OH-后,使[H+]下降,水解平衡向正反应方向移动;
(2) 溶液变成原来的颜色; H2SO4完全中和所加的NaOH,平衡恢复原状况;
(3) 溶液变成橙色; c(H+)增大,平衡向左移动,使c(Cr2O72-)增大
1.D 2.B 3.D 4.AD 5.A 6.B 7.D 8. B 9.CD 10.D 11.D 12.AC 13.BD 14.A 15.AC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com