
5.将体积都为10 mL、pH都等于3的醋酸和盐酸,加水稀释至a mL和b?mL,测得稀释后溶液的pH均为5。则稀释后溶液的体积 ( )
A.a=b=100 ml B.a=b=1000mL C.a<b D.a>b
(本题考查学生的知识点是pH的计算以及加水稀释对强弱电解质的不同影响)
4.重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg[D+],以下关于pD的叙述正确的是:
( )
A、 中性溶液的pD=7.0
B、 B、含0.01mol的NaOD的D2O溶液1L,其pD=12.0
C、溶解0.01molDCl的D2O溶液1L,其pD=2.0
D、在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液,其pD=1.0
(该题是信息题,考查了学生利用已有水的电离和离子积的知识处理信息题的能力)
3.下列溶液肯定是酸性的是 ( )
A 含H+的溶液 B 加酚酞显无色的溶液
C pH<7的溶液 D [OH-]<[H+]的溶液
(本题考查了学生能否正确判断溶液酸碱性,要把握判断的关键即c(H+)>c(OH-) )
2.用pH试纸测定无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
(本题考查学生对用pH试纸测定溶液的pH规范操作的掌握)
1.下列叙述正确的是 ( )
A pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B 溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
(本题涉及溶液的酸碱性的判断、pH的计算、电解质的概念,水的离子积常数)
4.现有下列两组溶液(Ⅰ)组:0.1mol/L的醋酸和盐酸,(Ⅱ)组:pH值=11的氨水和氢氧化钠溶液。若将它们加水稀释相同的倍数,试比较(Ⅰ)组和(Ⅱ)组
溶液pH值的大小:
(Ⅰ)组_______ _ ,
(Ⅱ)组_________ __。
(本题考查强酸(碱)、弱酸(碱)加水稀释时溶液的pH值变化情况,属于理解层次。可尝试运用图示法分析)
新活题网站
3.已知一种[H+]=1×10-3mol/L的酸和一种[OH-]=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是 ( )
A.浓的强酸和稀的强碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸的碱盐
(本题考查了酸碱混合反应,注重逻辑推理及思维的全面性,体现综合能力。注意pH的计算结合盐类水解的有关知识)
2.(全国高考题)在80℃时,纯水的pH值小于7,其原因是
。
(本题主要考查水的电离、pH值与水的离子积Kw之间的关系,以及Kw与温度的关系,涉及的概念较多,需仔细、深入地思考分析,理清各种关系才好作答。由于本题是简答题型,也考查文字表达能力)
1.(2001年上海高考)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念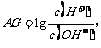 则下列叙述正确的是
( )
则下列叙述正确的是
( )
A 中性溶液的AG=0 B 酸性溶液的AG<0
C 常温下0.lmol/L氢氧化钠溶液的AG=12
D 常温下0.lmol/L盐酸溶液的AG=12
(该题是信息题,考查了学生利用已有溶液的酸碱性的知识处理信息题的能力,溶液酸性越强,酸度越大,把握好信息的涵义。)
4.酸混合、碱混合、酸碱混合pH计算:
酸算c(H+),碱先算c(OH-)后再转化为c(H+),再求pH,酸碱混合(一者过量)
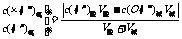
典型题点击
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com