
3.100℃时,(KW=1×10-12(mol/L)2)对纯水的叙述正确的是 ( ) A.pH=6显弱酸性 B.[H+]=10-6mol/L,溶液为中性 C.KW是常温时的10-2倍 D.温度不变冲稀10倍pH=7
2.在100mL 0.1mol/L CH3COOH溶液中,欲使CH3COOH的电离程度和溶液的pH值都增大,可采用的方法是( ) A、加少量的NaOH(1mol/L)溶液 B、加少1mol/L盐酸 C、加100mL水 D、微热
1.向纯水中加入少量的KHSO4固体(温度不变),则溶液的( )
A、pH值升高 B、c(H+)和c(OH-)的乘积增大
C、酸性增强 D、OH-离子浓度减小
4. 25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”) _____,
其理由是___________________
(2)a值可否等于5(填“可”或“否”)_ ,其理由是____________________
(3)a的取值范围是
_______________________________________。
检测提高
3. (1997年上海高考)在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是 ( )
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
2.再室温下.某溶液中由水电离的H+浓度为1.0×10-13mol/L-1,则此溶液中一定不可能大量存在的离子组是( )
A.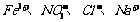
B.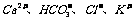
C.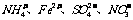
D.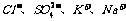
1.(2000年全国高考)室温下,在pH=12的某溶液中,由水电离的c(OH-)为 ( )
A.1.0×10-7mol·L-1 B.1.0×10-6mol·L-1
C.1.0×10-2mol·L-1 D.1.0×10-12mol·L-1
4.常温下,再电解质溶液中,若水电离的H+浓度小于1×10-7mol/L学生常不能考虑到可能是酸或碱溶液,若水电离的H+浓度大于1×10-7mol/L一定盐类的水解。
纠错训练
3.在溶液混合过程中的pH计算,学生对碱和碱的混合求pH时,常把握不好,会忽略了水电离产生的c(H+)而导致错误,应先求c(OH-)混再求c(H+)混,最后求pH
2.判断溶液的酸碱性仅根据pH而不抓住关键-即比较c(H+)与c(OH-)的大小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com